Íon-fórmula
O íon-fórmula é aquele que indica a quantidade de átomos necessários para a formação de um determinado composto iônico. Um composto iônico é formado a partir da ligação iônica entre átomos com as seguintes características:
-
Metal (apresenta como principal característica a capacidade de perder elétrons quando está ligado a um ametal ou com o Hidrogênio);
-
Ametal (apresenta como principal característica a capacidade de ganhar elétrons quando está ligado a um metal);
-
Hidrogênio (apresenta como principal característica a capacidade de ganhar elétrons quando está ligado a um metal).
A construção de um íon-fórmula depende do conhecimento da carga ou NOX (número de oxidação) de cada um dos elementos envolvidos na formação do composto. O NOX envolve a relação entre o número de elétrons na camada de valência do átomo e a teoria do octeto.
-
Camada de valência: é a camada mais externa de um átomo. Para conhecermos o número de elétrons nessa camada, basta sabermos a família à qual pertence o átomo do elemento trabalhado (desde que ele seja representativo, ou seja, família A).
Não pare agora... Tem mais depois da publicidade ;)
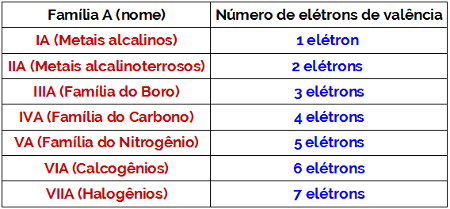
Relação entre família e número de elétrons na camada de valência
-
Teoria do octeto: Um átomo, para ser estável, deve apresentar dois ou oito elétrons na camada de valência. Essa estabilidade pode ser atingida de duas formas:
1a) Perdendo elétrons: quando um átomo perde seus elétrons de valência, passa a apresentar uma nova camada de valência com oito ou dois elétrons.
2a) Ganhando elétrons: quando um átomo ganha os elétrons que faltam para completar seu octeto na camada de valência, passa a apresentar dois ou oito elétrons.
Agora acompanhe nos exemplos abaixo a montagem do íon-fórmula com os seguintes elementos químicos:
Exemplo1: Magnésio (Mg) e Selênio (Se)
O elemento Magnésio é um metal (cuja capacidade é a de perder elétrons de valência, íon positivo) da família IIA (metal alcalinoterroso) que apresenta dois elétrons na camada de valência. Para estabilizar-se, ele deve perder 2 elétrons. Por isso, seu NOX é +2.
Mg2+
Já o elemento Selênio é um ametal (cuja capacidade é a de ganhar elétrons na camada de valência, íon negativo) da família VIA (calcogênio) que apresenta seis elétrons na camada de valência. Logo, deve receber dois elétrons para estabilizar-se. Por isso, seu NOX é -2.
S2-
Para montar o íon-fórmula, basta escrever o metal e depois o ametal, finalizando com o cruzamento das cargas estabelecidas anteriormente. Após o cruzamento, a carga do metal transforma-se na quantidade do ametal e vice-versa.
Mg2+ e S2-
Com o cruzamento:
Mg2S2
OBS.: Como cátion e ânion apresentam cargas com numeração 2, o número pode ser desprezado na escrita da fórmula.
MgS
Exemplo2: Potássio (K) e Iodo (I)
O elemento Potássio é um metal (íon positivo) da família IA (Metal alcalino) que apresenta um elétron na camada de valência. Para estabilizar-se, ele deve perder um elétron. Por isso, seu NOX é +1.
K1+
Já o elemento Iodo é um ametal (íon negativo) da família VIIA (Halogênio) que apresenta sete elétrons na camada de valência. Assim, deve receber um elétron para estabilizar-se. Por isso seu NOX é -1.
I1-
Para montar o íon-fórmula, basta escrever o metal e depois o ametal, finalizando com o cruzamento das cargas estabelecidas anteriormente. Após o cruzamento, a carga do metal transforma-se na quantidade do ametal e vice-versa.
K1+ e I1-
Com o cruzamento:
K1I1
OBS.: Como cátion e ânion apresentam cargas com numeração 1, o número pode ser desprezado na escrita da fórmula.
KI
Exemplo3: Alumínio (Al) e Cloro (Cl)
O elemento Alumínio é um metal (íon positivo) da família IIIA (família do boro) que apresenta três elétrons na camada de valência. Para estabilizar-se, ele deve perder três elétrons. Por isso, seu NOX é +3.
Al3+
Já o elemento Cloro é um ametal (íon negativo) da família VIIA (Halogênio) que apresenta sete elétrons na camada de valência. Ele deve receber, portanto, um elétron para estabilizar-se. Por isso, seu NOX é -1.
Cl1-
Para montar o íon-fórmula, basta escrever o metal e depois o ametal, finalizando com o cruzamento das cargas estabelecidas anteriormente. Após o cruzamento, a carga do metal transforma-se na quantidade do ametal e vice-versa.
Al3+ e Cl1-
Com o cruzamento:
Al1Cl3
OBS.: O número pode ser sempre desprezado na escrita da fórmula.
AlCl3
Exemplo4: Chumbo (Pb) e Hidrogenio (H)
O elemento Chumbo é um metal (íon positivo) da família VIA (família do carbono) que apresenta quatro elétrons na camada de valência. Para estabilizar-se, ele deve perder quatro elétrons. Por isso, seu NOX é +4.
Pb4+
Já o elemento Hidrogênio não possui família, apresenta um elétron na camada de valência e deve receber, portanto, um elétron para estabilizar-se. Seu NOX é -1.
H1-
Para montar o íon-fórmula, basta escrever o metal e depois o ametal, finalizando com o cruzamento das cargas estabelecidas anteriormente. Após o cruzamento, a carga do metal transforma-se na quantidade do ametal e vice-versa.
Pb4+ e H1-
Com o cruzamento:
Pb1H4
ou
PbH4
Exemplo5: Lítio (Li) e Nitrogênio (N)
O elemento Lítio é um metal (íon positivo) da família IA (Metal alcalino) que apresenta um elétron na camada de valência. Para estabilizar-se, ele deve perder um elétron. Seu NOX é +1.
Li1+
Já o elemento Nitrogênio é um ametal (íon negativo) da família VA (família do Nitrogênio) que apresenta cinco elétrons na camada de valência. Ele deve receber três elétrons para estabilizar-se. Por isso, seu NOX é -3.
N3-
Para montar o íon-fórmula, basta escrever o metal e depois o ametal, finalizando com o cruzamento das cargas estabelecidas anteriormente. Após o cruzamento, a carga do metal transforma-se na quantidade do ametal e vice-versa.
Li1+ e I1-
Com o cruzamento:
Li3N1
Ou
Li3N