Compostos iônicos
Os compostos iônicos são caracterizados pela união entre elementos metálicos e não metálicos, por meio de uma transferência de elétrons, resultando em íons. A diferença de eletronegatividade entre esses tipos de elementos é a responsável pelas características dos compostos formados e pela elevada força de atração entre eles.
Leia também: Entenda a a ionização dos ácidos
Definição de compostos iônicos
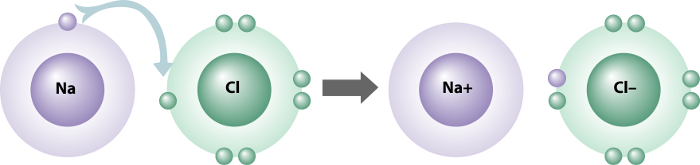
Compostos iônicos são formados por íons unidos por forças eletrostáticas, esse tipo de compostos, chamados de ligações iônicas, são ligações entre um metal e um ametal. O elemento metálico possui uma tendência a formar cátions, isto é, perde um elétron para o ametal, que o absorve, formando um ânion.
Para exemplificar, usaremos os átomos de sódio, Na (metal), e o cloro, Cl (ametal), que não são estáveis nos estados fundamentais. Para se tornar estável, é necessário que o átomo de sódio perca o único elétron de sua camada de valência e o cloro, com 7 elétrons na última camada, necessita de receber um elétron para adquirir a estabilidade (regra do octeto).
Com essa transferência de elétron de um átomo para outro, é gerada uma força de atração entre os átomos, formando, assim, a ligação iônica, considerada forte em relação aos outros tipos de ligação entre átomos.
Características dos compostos iônicos
Os compostos iônicos organizam-se na forma de retículos cristalinos, ou seja, um aglomerado de íons organizados forma a estrutura dos compostos iônicos. Seguindo o exemplo descrito anteriormente, o NaCl, pode ser representado da seguinte forma:
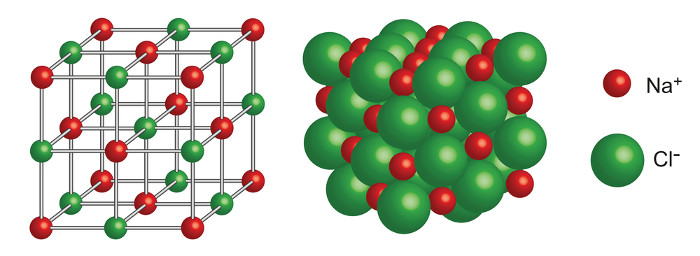
A forte atração entre os íons e a estrutura dos compostos iônicos explicam algumas propriedades apresentadas a seguir:
- Altas temperaturas de fusão e ebulição, pelo fato de a força de atração ser alta entre os átomos envolvidos, são necessárias altas temperaturas para que tenha o rompimento dessa força e a mudança de estado físico.
- Os compostos iônicos são sólidos na temperatura ambiente, o que se justifica pela propriedade anterior.
- São duros e quebradiços. A estrutura dos retículos cristalinos (cátions e ânions intercalados) conferem um alto grau de dureza para esses compostos.
- São bons condutores de eletricidade quando no estado líquido e dissolvidos em água, mas não conduzem no estado sólido. Os íons que compõem a substância permitem a passagem de corrente elétrica quando estão livres, no estado líquido, ou dissolvidos na água, considerada um dos melhores solventes para os compostos iônicos (alguns compostos, como CaCO3 e AgCl, são considerados exceções e, apesar de polares, são insolúveis em água).
Saiba mais: Descubra o que é radiação ionizante
Exercícios resolvidos
Vamos ver alguns exemplos de exercícios sobre compostos iônicos e ligações químicas:
Questão 01 - (Cefet-MG) Ao reagir um metal alcalino-terroso do terceiro período da Tabela Periódica dos Elementos com um halogênio do segundo período forma-se um composto _______________ de fórmula ____________.
Os termos que completam corretamente as lacunas são, respectivamente,
a) iônico e MgF2.
b) iônico e Na2O.
c) molecular e Na2S.
d) molecular e MgCl2.
O metal alcalino terroso do 3º período é o Mg, magnésio, e o halogênio do 2º período, o F, flúor. Por se tratar de uma ligação entre um metal e um ametal, estamos falando de uma ligação iônica, o que irá resultar em um composto iônico.
O Mg possui dois elétrons na última camada e para se tornar estável deve perder esses elétrons, tornando-se um cátion, Mg2+. O F, possui 7 elétrons na camada de valência e deve ganhar 1 elétron para se tornar estável, formando o ânion F-. Ao unir os dois íons, é necessário que se tenha dois F- para neutralizar a carga do Mg2+, o que irá resultar no composto MgF2.
Portanto, a resposta do exercício LETRA A.
Questão 02 - (EsPCEX) Compostos iônicos são aqueles que apresentam ligação iônica. A ligação iônica é a ligação entre íons positivos e negativos, unidos por forças de atração eletrostática. (Texto adaptado de: Usberco, João e Salvador, Edgard, Química: química geral, vol 1, pág 225, Saraiva, 2009).
Sobre as propriedades e características de compostos iônicos são feitas as seguintes afirmativas:
I. apresentam brilho metálico.
II. apresentam elevadas temperaturas de fusão e ebulição.
III. apresentam boa condutibilidade elétrica quando em solução aquosa.
IV. são sólidos nas condições ambiente (25 ºC e 1atm).
V. são pouco solúveis em solventes polares como a água.
Das afirmativas apresentadas estão corretas apenas
a) II, IV e V.
b) II, III e IV.
c) I, III e V.
d) I, IV e V.
e) I, II e III.
Julgando os itens do exercício:
I – ERRADO, pois o brilho metálico é característica dos compostos formados por ligações metálicas.
II – CORRETO, pois, devido às altas forças de atração entre os íons, os compostos iônicos irão apresentar altas temperaturas de fusão e ebulição.
III- CORRETO, pois os íons dissolvidos na água permitem a passagem da corrente elétrica.
IV- CORRETO, pois os compostos iônicos são sólidos na temperatura ambiente devido às elevadas temperaturas de fusão e ebulição.
V- ERRADO, pois a água é considerada um dos melhores solventes para os compostos iônicos, mas há algumas exceções.
