Ligação iônica
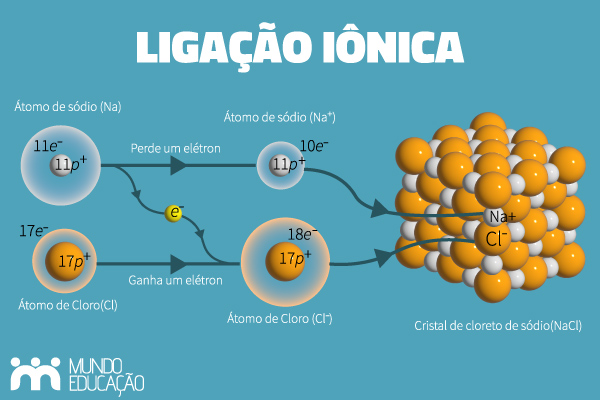
Ligação iônica é uma modalidade de ligação que ocorre por meio da atração eletrostática entre íons de cargas opostas. Essa ligação ocorre entre um metal e um ametal, pois o metal é propenso a formar cátions, enquanto o ametal é propenso a formar ânions. A ligação iônica produz compostos iônicos, os quais podem ser representados por íon-fórmulas. Entre as principais características dos compostos iônicos, estão o alto ponto de fusão, o fato de formarem sólidos quebradiços, além da condutibilidade elétrica quando dissolvidos em água ou fundidos.
Leia também: O que é uma ligação metálica?
Resumo sobre ligação iônica
- A ligação iônica é uma atração eletrostática entre íons de cargas opostas.
- Para a ocorrência de uma ligação iônica, é preciso de um elemento metálico e de um elemento ametal.
- Compostos iônicos têm alto ponto de fusão, são quebradiços e conduzem eletricidade quando dissolvidos em água ou fundidos.
- Uma forma de se representar compostos iônicos em textos é por meio da íon-fórmula, com ajuda das estruturas de Lewis.
Videoaula sobre ligação iônica
O que é ligação iônica
A ligação iônica é uma atração eletrostática que ocorre entre um cátion e um ânion, espécies cujas cargas são opostas. Percebe-se que ela só ocorre entre átomos com eletronegatividades bem diferentes; por isso, é observada na ligação entre metais (espécies eletropositivas, propensas a formar cátions) e ametais (espécies eletronegativas, propensas a formar ânions).
Principais características da ligação iônica
A ligação iônica, sendo uma atração eletrostática entre cargas opostas, apresenta uma força considerável e, por isso, os compostos iônicos são sólidos de alto ponto de fusão (e, consequentemente, de ebulição). Isso porque a interação entre as cargas dos íons nos compostos iônicos não é pontual, ou seja, apenas com a carga vizinha, mas sim com todos os íons presentes na estrutura.
Sendo sólidos, os compostos iônicos apresentam um grande estado de organização entre os íons, assim, todos os cátions presentes interagem, com maior ou menor grau, com todos os ânions presentes, assim como repelem, com maior ou menor grau, todos os cátions presentes. O mesmo serve para os ânions presentes. Isso justifica o alto ponto de fusão: é necessária uma alta temperatura para que os íons comecem a se mover uns em relação aos outros para a formação do líquido.

Outro ponto que chama atenção dos compostos iônicos é que eles são sólidos quebradiços. Quando golpeados com um objeto duro, como um martelo, os íons de cargas iguais são forçados a ficarem lado a lado, o que gera uma grande repulsão, ocasionando na quebra do sólido em fragmentos.
A solubilidade de compostos iônicos em água é um tanto quanto complexa. Isso porque a solubilidade será consequência da chamada energia de rede do sólido iônico, por sua vez, consequência das forças atrativas e repulsivas que existem nele. Basicamente, quanto maior a energia de rede, menor a solubilidade em água, visto que, para que haja dissolução, as moléculas de água devem romper essas forças atrativas.
Outro ponto importante é o ganho energético com a chamada hidratação dos íons. Quanto mais bem hidratados forem os íons, ou seja, quanto melhor forem envoltos por moléculas de água, propiciando uma boa interação soluto-solvente, mais facilitada fica a dissolução. De forma geral, percebe-se que quando o cátion ou o ânion apresenta uma baixa densidade de carga (ou seja, carga pequena com um volume grande), a solubilidade em água é favorecida.
Por exemplo, compostos iônicos de clorato (ClO3−), perclorato (ClO4−), nitrato (NO3−) e acetato (CH3COO−) são muito solúveis em água, já que apresentam baixa densidade de carga. Ao passo que muitos sulfetos (S2−), óxidos (O2−), carbonatos (CO32−) e fosfatos (PO43−), com maior densidade de carga, são muito pouco solúveis em água.
Por exemplo, o óxido de césio, Cs2O, é solúvel em água, enquanto o óxido de magnésio, MgO, não. Isso pode ser explicado pelo fato de o cátion césio, Cs+, ser um cátion de baixa densidade de carga (raio grande, carga baixa), ao passo que o cátion magnésio, Mg2+, é um cátion de alta densidade de carga (raio pequeno, carga alta).
Por fim, os compostos iônicos que se dissolvem em água formam soluções eletrolíticas, ricas em íons, as quais são capazes de conduzir corrente elétrica. Como também há dissociação de íons quando cristais iônicos se fundem, ela acaba sendo uma forma de condução elétrica para compostos iônicos que não se dissolvem em água.
Veja também: Como é feita a distribuição eletrônica em um átomo?
Exemplos de ligação iônica

São exemplos de compostos que realizam ligações iônicas:
- Cloreto de sódio, NaCl, formado pela interação entre o cátion sódio Na+ e o ânion cloreto, Cl−.
- Sulfeto de magnésio, MgS, formado pela interação entre o cátion magnésio, Mg2+, e o ânion sulfeto, S2−.
- Fosfato de cálcio, Ca3(PO4)2, formado pela interação entre o cátion cálcio, Ca2+, e o ânion fosfato, PO43−.
- Nitrato de prata, AgNO3, formado pela interação entre o cátion prata, Ag+, e o ânion nitrato, NO3−.
- Sulfato de amônio, (NH4)2SO4, formado pela interação entre o cátion amônio, NH4+, e o ânion sulfato, SO42−.
Quais os elementos que fazem parte da ligação iônica?
A ligação iônica é feita por meio da atração eletrostática entre íons de cargas opostas. Isso só será possível entre dois elementos que tiverem tendências opostas na formação de íons.
Assim sendo, átomos mais eletropositivos, como os metais — que têm baixa energia de ionização de modo geral —, têm grande tendência a formar cátions, enquanto ametais —átomos mais eletronegativos e com alta afinidade eletrônica de modo geral — têm grande tendência a formar ânions. Por isso, é comum dizer que uma ligação iônica é formada sempre entre um metal e um ametal.
Outra forma de se pensar na ligação iônica tem a ver com a diferença da eletronegatividade entre os átomos envolvidos. Isso foi proposto por Linus Pauling, determinando que: quanto maior a diferença entre os valores de eletronegatividade, maior o caráter iônico da ligação.
Tal proposta é uma consequência de algo que se vê na prática, em que um composto não é puramente iônico, mas sim majoritariamente iônico. Por isso há a ideia de que quando a diferença de eletronegatividade entre os compostos é superior a 1,7, pode-se dizer que a ligação é majoritariamente iônica.
Como fazer uma ligação iônica?
Uma ligação iônica é formada, basicamente, por meio de três etapas:
- Os átomos metálicos, no estado gasoso, perdem elétrons, tornando-se cátions.
- Os elétrons então liberados se ligam aos átomos do ametal, também no estado gasoso, fazendo com que estes se tornem ânions.
- Os cátions e ânions resultantes unem-se, formando a ligação iônica.
Contudo, tal movimento somente ocorrerá se houver uma condição energeticamente favorável. Por exemplo, a energia para se retirar um elétron de um átomo de sódio isolado no estado gasoso é:
Na (g) → Na+ (g) + e− energia necessária: 494 kJ.mol−1
Já a afinidade eletrônica do cloro é de +349 kJ.mol−1, o que quer dizer que essa quantidade de energia é liberada quando o elétron se liga a ele para a formação do ânion cloreto.
Cl (g) + e− → Cl− (g) energia liberada: 349 kJ.mol−1
Olhando apenas essas duas etapas, percebe-se que a formação da ligação entre o cátion e o ânion não se justifica, pois o saldo energético é positivo, de +145 kJ.mol−1. Isso quer dizer que o processo, até então, é não espontâneo do ponto de vista termodinâmico, visto que mais gastou energia do que propriamente a liberou. Isso quer dizer que um gás de átomos de sódio e cloro isolados é mais estável termodinamicamente do que um gás de íons Na+ e Cl− separados.
Porém, quando íons Na+ e Cl− se unem para a formação do sólido iônico NaCl, vemos uma grande liberação de energia:
Na+ (g) + Cl− (g) → NaCl (s) energia liberada: 787 kJ.mol−1
Agora, vemos uma queda substancial na energia total do processo, de modo que o balanço de energia do processo global, Na (g) + Cl (g) → NaCl (s), é de −642 kJ.mol−1, indicando que, termodinamicamente, um sólido iônico formado entre sódio e cloro é mais estável que uma mistura gasosa de átomos de sódio e cloro separados.
Assim, uma ligação iônica ocorrerá se a energia liberada na junção dos íons for maior do que a energia necessária para a formação desses íons. Daí se entende o porquê de a ligação iônica ser feita entre metais e ametais: apenas metais possuem energia de ionização suficientemente baixa para a formação de ligações iônicas energeticamente favoráveis, assim como os ametais possuem alta afinidade eletrônica, o que auxilia no balanço de energia.
Fórmula eletrônica de Lewis
A fórmula eletrônica de Lewis foi uma proposta feita por Gilbert Newton Lewis, cientista pioneiro no campo da compreensão das ligações químicas. A ideia é demonstrar, didaticamente, os elétrons de valência de cada espécie para justificar a formação das espécies iônicas. Nessa formulação, cada ponto adjacente ao símbolo do elemento corresponde a um elétron de valência.
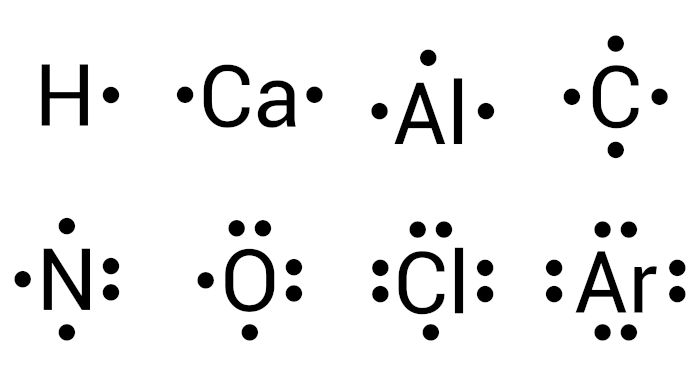
Por exemplo, o cálcio é um metal alcalino-terroso de número atômico 20. Ao se fazer sua distribuição eletrônica, temos: 1s2 2s2 2p6 3s2 3p6 4s2. Dessa forma, o cálcio tem dois elétrons de valência, e, na fórmula de Lewis, representamos esses dois elétrons por meio de dois pontos, conforme visto na imagem anterior.
Íon-fórmula
Quando queremos representar compostos iônicos, podemos utilizar as íon-fórmulas. Isso porque compostos iônicos não formam moléculas, portanto, não é correto utilizar a terminologia “fórmula molecular”. Por exemplo, o átomo de sódio possui apenas 1 elétron de valência, enquanto o átomo de cloro possui 7 elétrons de valência. Portanto, pode-se entender que o átomo de sódio perde seu elétron de valência, formando o íon Na+. O átomo de cloro recebe o elétron, tornando-se o ânion Cl−.
O número de elétrons cedidos ou recebidos é totalmente ligado à regra do octeto, ou seja, ao número de elétrons necessários para estabilização. O sódio, ao perder um elétron, fica com a distribuição 1s2 2s2 2p6, com octeto completo, assim como o cloro, cuja distribuição passa a ser 1s2 2s2 2p6 3s2 3p6, também com octeto completo. Assim, chega-se à íon-fórmula NaCl.
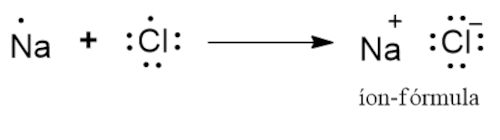
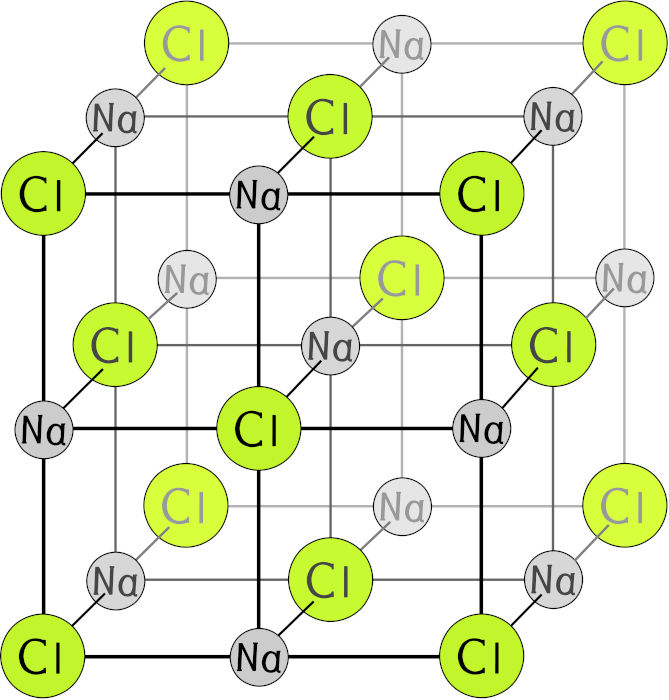
A íon-fórmula representa a fórmula unitária do cristal iônico. Isso porque, no cristal de cloreto de sódio, cada íon de sódio está rodeado por seis íons cloreto, os quais também estão rodeados, cada um, por seis íons de sódio. Portanto, a íon-fórmula representa a fórmula mínima necessária para a compreensão do cristal iônico.
Ligação iônica x ligação covalente
A ligação covalente, diferentemente da ligação iônica, ocorre por meio do compartilhamento de elétrons de valência entre as duas espécies, que acabam criando uma região de alta densidade eletrônica entre eles, com uma força de atração muito característica. Em oposição aos compostos iônicos, os compostos covalentes são chamados de moléculas, as quais podem existir isoladamente.
Já a força da ligação covalente é puramente dependente do tamanho dos átomos envolvidos. Quanto maior forem os átomos, mais fracas serão as ligações, visto que menor será a força de atração entre os núcleos atômicos e os elétrons da ligação.
Na natureza, compostos covalentes são encontrados em todos os estados físicos, ou seja, na forma sólida, líquida ou gasosa, pois seus estados físicos são totalmente dependentes das forças de interação entre as moléculas, as quais têm grande variedade de intensidade. Por fim, a ligação covalente ocorre entre dois ametais, ou seja, não envolvendo elementos metálicos na sua formação.
Saiba mais: O que diz a regra do octeto?
Exercícios resolvidos sobre ligação iônica
Questão 1. (USS Univassouras Medicina/2023.2) Uma solução antisséptica é preparada com os seguintes componentes: I2, KI, C2H5OH e H2O.
Dentre esses componentes, aquele que apresenta ligação interatômica iônica, corresponde ao:
- I2
- KI
- C2H5OH
- H2O
Resposta: Letra B.
A substância KI é a única formada entre um metal (K) e um ametal (I), condição necessária para a formação de uma ligação iônica. Os demais compostos apresentam apenas ametais em suas respectivas estruturas.
Questão 2. (UNITAU Inverno Medicina/2022) Uma substância sólida apresenta as seguintes características: não condução de corrente elétrica no estado sólido, solubilidade em água, condução de corrente elétrica em solução aquosa e fase líquida, alto ponto de fusão (acima de 900 °C) e elevada dureza.
Com base nos modelos de ligação química, trata-se de um sólido
- metálico
- covalente
- iônico
- molecular
- intermolecular
Resposta: Letra C.
As descrições correspondem às de um sólido iônico quando dizem respeito à falta de condução elétrica no estado sólido (se houvesse, seria um sólido metálico), à solubilidade em água, à condução em solução aquosa e à fase líquida, além de alto ponto de fusão (os sólidos covalentes têm ponto de fusão um pouco menor).
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DUARTE, H. A. Ligações Químicas: Ligação Iônica, Covalente e Metálica. Química Nova na Escola. n. 4. mai. 2001.
HOUSECROFT, C. E.; SHARPE, A. G. Inorganic Chemistry. 4. ed. Harlow (Inglaterra): Pearson Education Limited, 2012.
HURST, M. O.; FORTENBERRY, R. C. Factors affecting the solubility of ionic compounds. Computational and Theoretical Chemistry. v. 1069, p. 132-137, out. 2015.