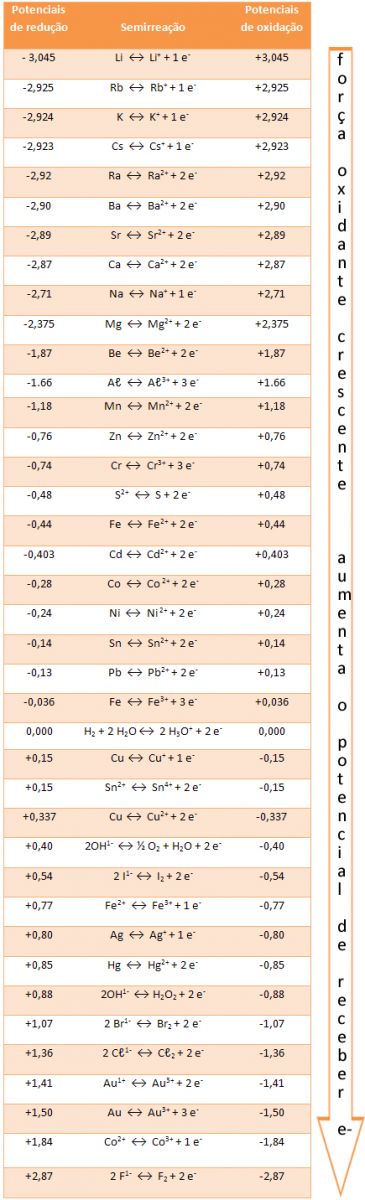
Potencial-padrão de redução das pilhas
Uma pilha pode ser definida como um equipamento que consegue converter energia química em energia elétrica. Para tal, ela precisa conter dois eletrodos, o cátodo e o ânodo, que são formados por diferentes metais, por onde os elétrons irão fluir gerando a corrente elétrica.
Conforme explicado no texto Diferença de potencial de uma pilha, esse fluxo de elétrons sempre irá correr no sentido do ânodo para o cátodo, isto é, do eletrodo que tem menor potencial de redução para o eletrodo que possui maior potencial de redução. Além disso, foi mostrado o exemplo da pilha de Daniell, que tem a força eletromotriz ou diferença de potencial entre os eletrodos igual a 1,10 V.
Encontramos esse valor diminuindo o potencial-padrão (de redução ou de oxidação) de um eletrodo por outro. No caso dessa pilha, o cátodo é o cobre e o ânodo é o zinco. Os potenciais-padrão de redução de cada um são + 0,34V e – 0,76 V, respectivamente. Fazendo a conta, temos:
ΔE0 = E0red (maior) - E0 red (menor)
ΔE0 = Ered Cu2+ - Ered Zn2+
ΔE0 = + 0,34 – (- 0,76)
ΔE0 = + 1,10 V
Mas daí surge uma questão: De onde surgiram os valores dos potenciais-padrão de redução desses dois metais?
Para poder calcular a força eletromotriz de uma pilha, convencionou-se medir o potencial (de redução e de oxidação) de cada eletrodo em relação a um eletrodo padrão, isto é, um eletrodo que estivesse em condições padrão e que serviria de referência para se comparar com os demais eletrodos.
O escolhido foi o eletrodo de hidrogênio, que é formado por um fio de platina (Pt) com uma placa de platina na ponta dentro de um tubo de vidro que está preenchido com gás hidrogênio (H2) sob pressão de 1 atm. O gás hidrogênio fica adsorvido na placa de platina, que é inerte e não participa da reação. Esse conjunto fica mergulhado numa solução de ácido sulfúrico de concentração 1 mol/L, em temperatura de 25ºC ou 298 K.
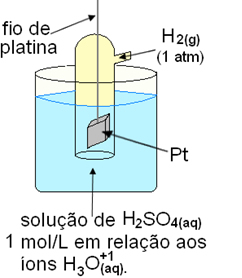
Adotou-se por convenção que os potenciais-padrão de redução e de oxidação normais do hidrogênio, medidos em condições padrão, são iguais a zero.
Portanto, ligando o eletrodo de hidrogênio com um eletrodo de outro metal, medimos a diferença de potencial dessa pilha formada com um voltímetro e, então, sabemos o valor do potencial-padrão do metal.
Por exemplo, digamos que formemos uma pilha em que um eletrodo é de zinco e o outro é o de hidrogênio. O valor medido no voltímetro é igual a - 0,76 V.
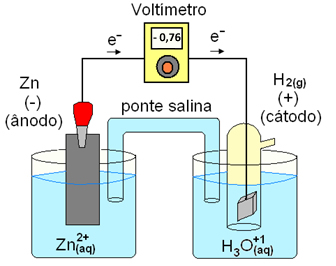
O fato de ter dado um valor negativo indica que a corrente está fluindo do eletrodo de zinco para o eletrodo de hidrogênio. Isso significa que nesse caso o zinco é o ânodo (polo negativo, onde o zinco metálico sofre oxidação, perdendo elétrons), e o hidrogênio é o cátodo (polo positivo, onde os cátions de hidrogênio sofrem redução, ganhando elétrons).
Sabendo que o potencial-padrão do hidrogênio é igual a zero, podemos descobrir o potencial-padrão do zinco:
Semirreação do ânodo: Zn( s) ↔ Zn2+(aq) + 2 e-
Semirreação do cátodo: 2 H3O+(aq) + 2 e- ↔ H2(g) + 2 H2O(?)
ΔE0 = E0red (cátodo) - E0 red (ânodo)
- 0,76 = Ered H2 - Ered Zn2+
- 0,76 = 0 - Ered Zn2+
Ered Zn2+ = - 0,76 V
Assim, descobrimos que o potencial-padrão de redução do zinco é – 0,76 V. O seu potencial-padrão de oxidação é numericamente igual, mas com sinal contrário, isto é, +0,76 V.
Agora considere uma pilha formada entre o eletrodo de cobre e o de hidrogênio:
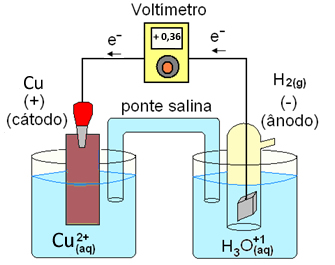
Dessa vez, o voltímetro marcou um valor positivo, igual a + 0,34. Isso quer dizer que agora ocorre o contrário da pilha anterior, a corrente está fluindo do eletrodo de hidrogênio para o eletrodo de cobre. O hidrogênio é o ânodo (polo negativo, onde o gás hidrogênio sofre oxidação, perdendo elétrons), e o cobre é o cátodo (polo positivo, onde os cátions de cobre sofrem redução, ganhando elétrons).
Seguindo o mesmo raciocínio da pilha anterior, temos:
Semirreação do ânodo: H2(g) + 2 H2O(?) ↔ 2 H3O+(aq) + 2 e-
Semirreação do cátodo: Cu2+(aq) + 2 e- ↔ Cu( s)
ΔE0 = E0red (cátodo) - E0 red (ânodo)
+ 0,36 = Ered Cu2+ - Ered H2
+ 0,36 = Ered Cu2+ - 0
Ered Cu2+ = + 0,36 V
O potencial-padrão de redução do cobre é igual a + 0,36 V e o seu potencial-padrão de oxidação é + 0,36 V.
Desse modo foi possível obter experimentalmente os valores de potenciais-padrão de redução de vários metais e os de oxidação dos seus cátions. Também foram obtidos os potenciais-padrão de oxidação de alguns ametais e de redução de seus ânions. Esses valores estão na tabela abaixo: