Transformação isobárica ou Lei de Gay-Lussac

| Uma transformação isobárica é uma variação do volume e da temperatura de determinado gás, porém com a pressão constante. |
Daí o significado do termo “isobárica”, que é uma palavra que vem do grego: iso = igual; e baros = pressão; ou seja, a pressão permanece igual, não varia.
Esse fenômeno foi estudado em 1802, pelo cientista francês Joseph Louis Gay-Lussac (1778-1850). Ele realizava experimentos como o mostrado abaixo, em que há em um recipiente um determinado gás, que, então, tem sua temperatura elevada, ou seja, o sistema recebe calor. Com isso, a energia cinética das partículas aumentará, isso significa que quanto maior a temperatura, maior será a velocidade das moléculas desse gás e vice-versa. A pressão se manteve constante, mas, com o aumento da velocidade das partículas, o volume ocupado por esse gás tende a aumentar.
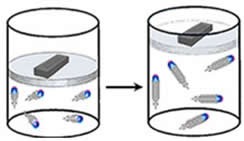
Com o aumento da temperatura e a pressão sendo mantida constante, a energia cinética das partículas irá aumentar, aumentando também o volume ocupado.
Esse princípio ficou conhecido como Lei de Gay-Lussac, que pode ser enunciada da seguinte maneira:
| Lei de Gay-Lussac: para uma massa fixa de gás, mantida à pressão constante, o volume ocupado pelo gás é diretamente proporcional à temperatura absoluta. |
Isso significa que com o aumento da temperatura, o volume também aumentará e vice-versa.
Isso pode ser visto com um experimento simples: ao colocarmos um balão em um recipiente com água quente, sua temperatura aumentará e seu volume também. Isso é visto pelo enchimento do balão. Já ao ser colocado em um recipiente com água e gelo, ele murchará, ou seja, com a diminuição da temperatura, o volume ocupado pelo gás também diminui.

Um balão inserido em uma garrafa, colocado em um recipiente com água quente, encherá com o aumento do volume do gás dentro dele. Ao ser colocado na água e gelo, ele murcha, pois seu volume diminui.
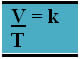
Se a temperatura dobrar, o volume também dobrará, se a temperatura triplicar, o mesmo ocorrerá com o volume e assim sucessivamente:
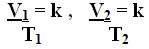
Assim, temos:
.jpg)
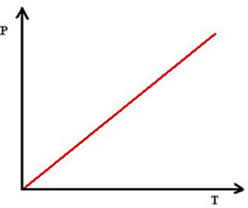
Graficamente, isso é representado por uma reta:
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias




















