Propriedades dos Sais Orgânicos

Conforme dito no texto Sais de Ácidos Carboxílicos, os sais orgânicos são obtidos por meio da reação entre um ácido carboxílico e uma base, em que o hidrogênio da carboxila é substituído pelo metal da base (ou pelo íon amônio) e origina o sal em questão, além de água.
Genericamente, temos:
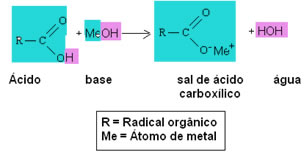
Observe que o sal formado é um composto iônico, portanto todas as propriedades desses sais são de compostos iônicos. A parte da cadeia carbônica desses sais é apolar, enquanto a extremidade é altamente polar, sendo formada pela atração entre cátions e ânions.
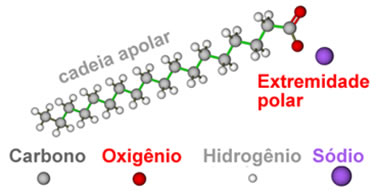
Veja algumas das propriedades que resultam dessa estrutura:
- Pontos de fusão e de ebulição:
Devido à presença de cargas elétricas de sinais opostos, há uma forte atração eletrostática que une os íons do sal, assim, é preciso uma quantidade grande de energia para romper as atrações entre as moléculas, por isso seus pontos de fusão e de ebulição são elevados.
- Estado de agregação:
A atração entre os íons das moléculas dos sais acaba produzindo aglomerados com formas geométricas bem definidas chamadas de retículos cristalinos. Visto que apresentam forma definida, apresentam-se como sólidos cristalinos nas condições ambientes (temperatura de 25°C e pressão de 1 atm).
- Solubilidade:
A maioria dos sais derivados de ácidos carboxílicos é solúvel em água, porque ela é polar e, como já mencionado, eles possuem uma extremidade altamente polar. No entanto, no caso dos sais formados por metais pesados, tais como o ferro, o cobre e a prata, eles são praticamente insolúveis.
- Densidade:
Por serem sólidos, costumam apresentar densidade mais elevada que a da água.
- Reatividade:
Realizam as mesmas reações que os sais inorgânicos. Se possuírem ligações duplas ou triplas, também poderão sofrer as mesmas reações que ocorrem com cadeias carbônicas insaturadas.
Na presença de água, eles sofrem hidrólise e regeneram o ácido e a base que lhes deram origem.
No exemplo abaixo, o sal etanoato de amônio sofre hidrólise e forma o ácido etanoico ou ácido acético e a base hidróxido de amônio:



