Calor latente
O calor latente é o tipo de calor que, quando transmitido para uma amostra, modifica o seu estado físico (ou fase) sem variar a sua temperatura. Quando o calor latente modifica o estado físico da amostra de líquido para o sólido, e vice-versa, ele é chamado de calor latente de fusão. Já quando o calor latente modifica o estado físico da amostra de líquido para gasoso, e vice-versa, ele é chamado de calor latente de vaporização.
Leia também: 5 coisas que você precisa saber sobre o calor
Resumo sobre o calor latente
- O calor latente é o calor capaz de alterar o estado físico de uma amostra sem a elevação de sua temperatura.
- Pode ser de fusão ou de vaporização.
- É calculado pela razão entre a quantidade de calor e a massa.
- Enquanto no calor latente ocorre mudança do estado físico sem aumento da temperatura do corpo; no calor sensível, ocorre a variação da temperatura sem que ocorra a mudança do estado físico do corpo.
O que é calor latente?
Também chamado de calor de transformação, o calor latente é a transformação da energia térmica em energia potencial de agregação das moléculas e dos átomos, ocasionando a alteração do seu estado de agregação da matéria (sólido, líquido ou gasoso).
Por exemplo, quando aumentamos a temperatura de uma amostra até determinada temperatura e depois a mantemos sob temperatura constante, logo em seguida, será possível observar a sua mudança de estado físico do sólido para o líquido, do líquido para o gasoso ou até do sólido para o gasoso. Da mesma forma, quando diminuímos a temperatura da amostra, será possível observar a sua mudança de estado físico do gasoso para o líquido, do líquido para o sólido ou até do gasoso para o sólido.
Tipos de calor latente
Existem dois tipos de calor latente, o calor latente de fusão e o calor latente de vaporização. Entenda um pouco sobre eles a seguir.
→ Calor latente de fusão
Ocorre quando a amostra absorve calor (e ganha energia), alterando o seu estado físico de sólido para líquido, ou libera calor (e perde energia), alterando o seu estado físico de líquido para sólido. Isso ocorre, por exemplo, na transformação de um cubo de gelo em água (mantendo a temperatura constante).
→ Calor latente de vaporização
O calor latente de vaporização ocorre quando a amostra absorve calor (e ganha energia), alterando o seu estado físico de líquido para gasoso, ou libera calor (e perde energia), alterando o seu estado físico de gasoso para líquido. Isso ocorre, por exemplo, quando fervemos a água e ela se transforma em vapor (mantendo a temperatura constante).
Fórmula do calor latente
A fórmula pela qual o calor latente pode ser calculado é a seguinte:
\(L=\frac{Q}{m}\)
- L → calor latente, medido em [J/kg] ou [cal/g].
- Q → quantidade de calor, medida em Joule [J] ou calorias [cal] .
- m → massa, medida em quilograma [kg] ou gramas [g].
Exemplo:
Uma amostra de substância recebe 200.000 calorias de calor para que ocorra uma vaporização completa. Sabendo que a massa dessa substância era de 400 gramas, determine o calor latente de vaporização da amostra.
Resolução:
Calcularemos o calor latente de vaporização pela sua fórmula:
\(L=\frac{Q}{m}\)
\(L=\frac{200\ 000}{400}\)
\(L=500\ cal/g\)
Tabela de calor latente
Abaixo estão descritos os calores latentes de fusão e de vaporização de algumas substâncias:
|
Substâncias |
Calor latente de fusão (kJ/kg ) |
Calor latente de vaporização (kJ/kg ) |
|
Hidrogênio |
58,0 |
455 |
|
Oxigênio |
13,9 |
213 |
|
Mercúrio |
11,4 |
296 |
|
Água |
333 |
2256 |
|
Chumbo |
23,2 |
858 |
|
Prata |
105 |
2336 |
|
Cobre |
207 |
4730 |
Calor latente x calor sensível
O calor latente (ou calor de transformação) e o calor sensível (ou calor específico) são tipos de calor, mas apresentam algumas diferenças. Enquanto no calor latente temos a mudança do estado físico do corpo, no calor sensível temos o aumento da temperatura sem a mudança do estado físico. O calor sensível pode ser calculado pela fórmula:
\(Q=m\cdot c\cdot∆T\)
- Q → quantidade de calor, medida em Joule [J] ou calorias [cal] .
- m → massa, medida em quilograma [kg] ou gramas [g] .
- c → calor específico, medido em [J/(kg∙K)] ou [cal/g∙°C] .
- ∆T → variação de temperatura, medida em Kelvin [K] ou Celsius [°C] .
Para saber mais sobre o calor sensível, clique aqui.
Exercícios resolvidos sobre calor latente
Questão 1
(Uerj) O gráfico abaixo indica o comportamento térmico de 10 g de uma substância que, ao receber calor de uma fonte, passa integralmente da fase sólida para a fase líquida.
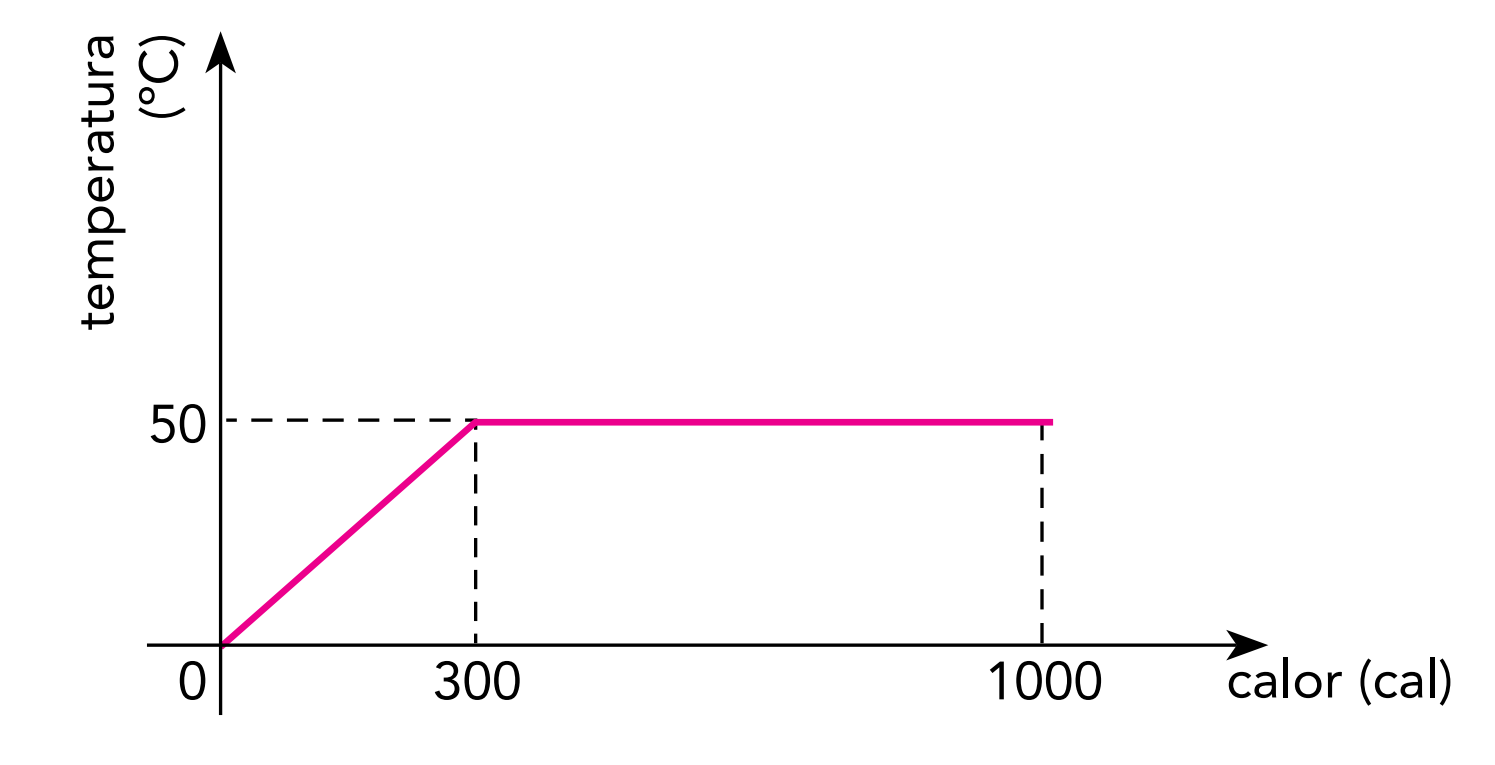
O calor latente de fusão dessa substância, em cal/g, é igual a:
A) 70
B) 80
C) 90
D) 100
Resolução:
Alternativa A
Calcularemos o calor latente de fusão pela sua fórmula:
\(L=\frac{Q}{m}\)
\(L=\frac{(1000-300)}{10}\)
\(L=\frac{700}{10}\)
\(L=70\ cal/g\)
Questão 2
(Unievangélica) Leia o texto a seguir.
Black (1935) discute um conceito que envolve a transição de fase, na qual há uma liberação ou absorção de calor que não envolve variações na temperatura mensuráveis pelo termômetro.
ZANOTELLO, Marcelo. Leitura de textos originais de cientistas por estudantes do Ensino Superior. Ciênc. Educ. (Bauru) [online], v. 17, n. 4, p. 992, 2011.
O texto descreve o calor:
A) molar.
B) sensível.
C) latente.
D) específico.
Resolução:
Alternativa C
Nesse texto é descrito o calor latente, já que ele ocorre quando não temos variações de temperatura, mas de estado físico.
Fontes
HALLIDAY, David; RESNICK, Robert; WALKER, Jearl. Fundamentos da Física: Gravitação, Ondas e Termodinâmica. vol. 2. 10. ed. Rio de Janeiro, RJ: LTC, 2016.
NUSSENZVEIG, Herch Moysés. Curso de física básica: Fluidos, Oscilações e Ondas, Calor. vol. 2. Editora Blucher, 2015.


