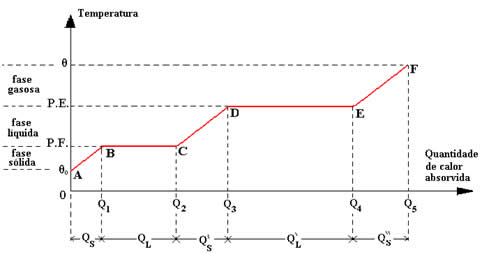
Curva de aquecimento
Ao estudarmos os conceitos de Calor, vimos que quando dois corpos com temperaturas diferentes são colocados em contato térmico, a temperatura do corpo mais quente começa a diminuir enquanto a do corpo mais frio começa a aumentar. Dessa forma, dizemos que o corpo mais quente perde energia na forma de calor para o corpo com menor energia térmica. Vimos também que a quantidade de calor que um corpo recebe ou perde (calor sensível) é proporcional à sua massa e à variação de temperatura. Já a quantidade de calor que um corpo perde ou cede para fazê-lo mudar de fase é diretamente proporcional à sua massa.
Todos esses processos, trocas de calor e mudanças de fase necessitam de acréscimo ou perda de energia térmica na forma de calor. Com informações da quantidade de calor sensível e calor latente de uma substância, temos condições de montar o diagrama de temperatura em função da quantidade de calor absorvida.
Imaginemos que, de uma forma constante, fornecemos calor a uma substância de m gramas, que inicialmente encontra-se na fase sólida. As etapas a que esta substância está sujeita são, em ordem:
- Aquecimento na fase sólida, desde a temperatura inicial θ0 até seu ponto de fusão (P.F.).
- Fusão da substância, ocorre com a temperatura constante no ponto de fusão (P.F.).
- Aquecimento na fase líquida, do ponto de fusão (P.F.) até o ponto de vaporização ou ebulição (P.E.).
- Vaporização da substância, ocorre com a temperatura constante no ponto de ebulição (P.E.).
- Aquecimento na fase gasosa, do ponto de vaporização ou ebulição (P.E.) até uma temperatura final θ.
Essas etapas, colocadas no diagrama de temperatura em função da quantidade de calor absorvida, correspondem à curva de aquecimento da substância representada na figura acima. Para se calcular as quantidades de calor absorvidas pela substância, é necessário levar em conta os trechos em que há variação da temperatura (quantidade de calor sensível) ou mudança de fase (quantidade de calor latente). Assim, temos:
trecho AB: QS= Q1-0=m .cs .(P.F.- θ0 )
trecho BC: Q1= Q2-Q1=m .LF
trecho CD: Q'S= Q3-Q2=m .cL .(P.E.- P.F.)
trecho DE: Q'L= Q4-Q3=m .LV
trecho EF: Q''S= Q5-Q4=m .cv .(θ-P.E.)