Primeira lei para processos isovolumétricos

A primeira lei da Termodinâmica explica os processos de conversão de energia em quaisquer sistemas fechados. Durante algumas transformações termodinâmicas, a substância de trabalho, como o vapor d'água, a gasolina ou o etanol, podem transformar calor em trabalho, por exemplo.
1ª lei da Termodinâmica
A primeira lei da Termodinâmica, também conhecida como lei da conservação da energia, é usada para calcular a parcela de energia recebida em forma de calor por um sistema fechado. Essa energia pode ser transformada em calor ou em trabalho de acordo com o tipo de transformação sofrida pela substância de trabalho (na maioria dos casos, gases).
O enunciado da primeira lei da termodinâmica é apresentado abaixo:
|
Todo o calor transferido para um sistema termodinâmico isolado pode ser parcialmente convertido em uma variação da energia interna do gás, bem como em trabalho termodinâmico. |
A fórmula que traduz o enunciado acima está explicitada abaixo:
![]()
ΔU – variação da energia interna
Q – calor
τ – trabalho termodinâmico
Veja também: As transformações termodinâmicas
O que é transformação isovolumétrica?
Transformações isovolumétricas são processos que ocorrem com substâncias de trabalho durante ciclos termodinâmicos sem que haja variações do volume dessas substâncias. Por exemplo: quando se cozinha um alimento em uma panela de pressão, a temperatura e a pressão no interior da panela aumentam sem que haja aumento do volume de água e de vapor de água.
Os processos isovolumétricos, também chamados de isométricos ou isocóricos, ocorrem quando há mudanças de pressão e de temperatura no interior de recipientes rígidos, ou seja, recipientes de volume invariável.
Nos processos isovolumétricos, a pressão e a temperatura são grandezas diretamente proporcionais, ou seja, um aumento de pressão acarreta um aumento de temperatura, e vice-versa.
A lei que determina o comportamento dos gases ideais que são sujeitos a transformações isovolumétricas é a lei de Gay-Lussac, cujo enunciado é mostrado abaixo:
|
A razão entre a pressão e a temperatura de um gás ideal, durante uma transformação isovolumétrica, é constante. |
Veja a seguir a fórmula que traduz matematicamente esse enunciado:
![]()
O diagrama de pressão por volume para esse tipo de transformação é mostrado abaixo. Perceba como, durante a transformação ab, o gás não teve seu volume alterado:
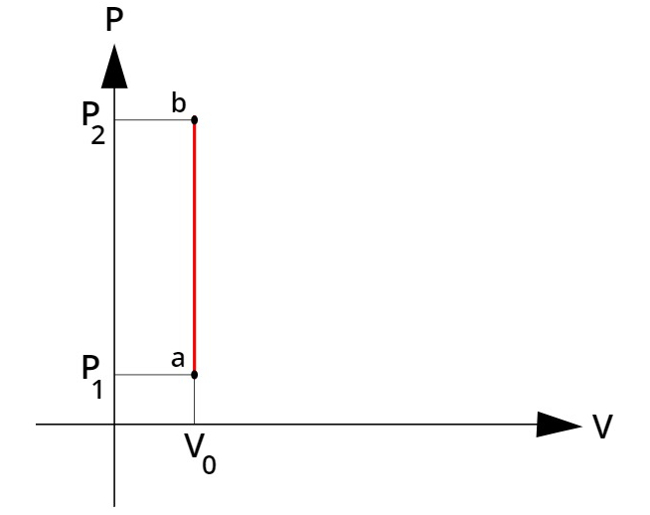
Compressão isovolumétrica: aumento da pressão sob volume constante.
Veja também: O que é trabalho termodinâmico?
1ª lei da Termodinâmica para processos isovolumétricos
Quando aplicamos a primeira lei da Termodinâmica aos processos isovolumétricos, percebemos que sua forma torna-se um pouco diferente daquela apresentada para os casos gerais. Nesses processos, os gases ou as substâncias de trabalho não se expandem nem se contraem para além das dimensões de seu recipiente, por isso, não são capazes de realizar trabalho termodinâmico, uma vez que o trabalho realizado depende diretamente da variação de volume:
![]()
τ - trabalho
P – pressão
ΔV – variação de volume
Veja também: Como funciona a panela de pressão?
Portanto, sendo nula a variação de volume em processos isovolumétricos, a primeira lei da Termodinâmica assume a seguinte forma:
![]()
ΔU – variação da energia interna
Q – calor
Logo, de acordo com a expressão mostrada acima, em transformações isométricas, toda a quantidade de calor fornecida ou cedida à substância de trabalho é integralmente convertida em aumento ou diminuição de sua energia interna.
Podemos determinar a quantidade de calor sensível fornecida em processos isométricos a partir da expressão abaixo:
![]()
QV – calor sensível no processo isovolumétrico
m – massa
cV – calor específico a volume constante
ΔT – variação de temperatura
A variação de energia interna, por sua vez, pode ser calculada de maneiras distintas de acordo com o número de graus de liberdade da substância de trabalho. Abaixo, mostramos somente os casos mais simples: variação da energia interna para gases monoatômicos ideais e para gases diatômicos ideais:
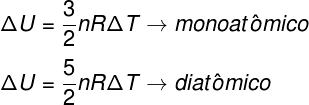
n – número de mols
R – constante universal dos gases ideais
Resumo sobre a 1ª lei da Termodinâmica para processos isovolumétricos
-
Transformações isovolumétricas são aquelas que ocorrem sem que haja variações no volume da substância de trabalho.
-
Nas transformações isovolumétricas, o gás não realiza trabalho, nem o sistema pode realizar trabalho sobre o gás, uma vez que o recipiente que o encerra é rígido.
-
Nas transformações isovolumétricas, toda a quantidade de calor cedida ou recebida pelo gás é integralmente convertida em variações de sua energia interna, refletindo em mudanças de temperatura.
-
Nas transformações isovolumétricas, pressão e temperatura são diretamente proporcionais.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















