Energia interna
A energia interna de um sistema termodinâmico é determinada pelo somatório da energia cinética e energia potencial das partículas que formam o sistema, dependendo apenas da grandeza temperatura. Em geral, ela pode ser calculada pelo produto entre os graus de liberdade, número de mols, constante universal dos gases ideais e variação da temperatura, tudo dividido por dois.
Leia também: Termologia — a área da Física que estuda as variações de calor e suas implicações
Resumo sobre energia interna
-
A variação da energia interna é dada pela diferença entre a energia interna final e a energia interna inicial.
-
A energia interna é medida em Joule.
-
A energia interna de um gás pode ser calculada pelo produto entre o número de mols, calor específico molar a volume constante e variação da temperatura.
-
A variação de energia térmica é dada pela subtração entre calor transferido e o trabalho realizado pelo sistema termodinâmico.
-
A variação de energia interna é nula na transformação isotérmica.
-
A variação de energia interna na transformação isovolumétrica varia com o calor transferido entre o sistema e o meio.
-
A variação de energia interna na transformação isobárica é igual à subtração entre o calor e o trabalho.
-
A variação de energia interna na transformação adiabática varia com o trabalho realizado pelo ou no sistema termodinâmico.
-
A energia interna em processos cíclicos é sempre zero, já que sempre volta ao seu estado inicial.
O que é energia interna?
A energia interna de um sistema termodinâmico é uma grandeza escalar física que pode ser definida como o somatório da energia cinética e energia potencial das partículas que compõem o sistema. A variação da energia interna é calculada por meio da fórmula:
\(∆U=U_f-U_i\)
-
\(∆U\) é a variação de energia interna, medida em Joule \([J ]\).
-
\(U_f\) é a energia interna final, medida em Joule \([J ]\).
-
\(U_i\) é a energia interna inicial, medida em Joule \([J ]\).
A energia interna muda de acordo com a variação da temperatura do sistema termodinâmico, sendo que à medida que aumentamos a temperatura, a energia interna aumenta, mas se diminuirmos a temperatura, a energia interna diminuirá.
Unidade de medida da energia interna
De acordo com o Sistema Internacional de Unidades (S.I.), a unidade de medida da energia interna é o Joule, representado pela letra J.
Energia interna de um gás ideal
A energia interna de um gás ideal é uma grandeza física que depende apenas da temperatura de um gás, mas não do processo que ocasionou a sua variação de temperatura nem de outras variáveis.
A fórmula geral da energia interna de um gás ideal para qualquer processo pode ser dada em termos do número de mols, variação da temperatura e graus de liberdade do gás — termo físico usado para caracterizar o estado físico de um sistema —, podendo ser graus de liberdade de rotação, translação e/ou oscilação:
\(∆U=\frac{L}2\cdot n\cdot R\cdot ∆T\)
-
\(∆U\) é a variação de energia interna do gás, medida em Joule \([J ]\).
-
L é o grau de liberdade do gás.
-
n é o número de mols do gás, medido em \([mol ]\).
-
R é a constante universal dos gases ideais, cujo valor é \(8,31\ J/mol\cdot K \) ou \(0,082\ atm\cdot L/mol\cdot K \).
-
\(∆T\) é a variação da temperatura, medida em Kelvin [K ].
Ele também pode ser dado em termos do calor específico molar de um gás a volume constante:
\(∆U=n\cdot c_v\cdot ΔT\)
-
\(∆U\) é a variação de energia interna do gás, medida em Joule \([J ]\).
-
n é o número de mols do gás, medido em \([mol ]\).
-
\(c_v\) é o calor específico molar a volume constante, medido em \([J/mol\cdot K]\)
-
\(∆T\) é a variação da temperatura, medida em Kelvin \([K ]\).
➝ Energia interna de um gás monoatômico
Os gases monoatômicos são aqueles que possuem átomos isolados, e não moléculas, como o hélio (He), neônio (Ne) e argônio (Ar). Os gases monoatômicos possuem três graus de liberdade, sendo três graus de translação, já que de acordo com a teoria quântica, átomos isolados não giram, portanto não possuem graus de rotação. Assim, a sua energia interna é dada pela fórmula:
\(∆U=\frac{3}2\cdot n\cdot R\cdot ∆T\)
-
\(∆U\) é a variação de energia interna do gás, medida em Joule \([J ]\).
-
n é o número de mols do gás, medido em \([mol ]\).
-
R é a constante universal dos gases ideais, cujo valor é \(8,31\ J/mol\cdot K \) ou \(0,082\ atm\cdot L/mol\cdot K \).
-
\(∆T \) é a variação da temperatura, medida em Kelvin \([K ]\).
A energia interna de um gás monoatômico também pode ser dada pela fórmula:
\(∆U=\frac{3}2\cdot p\cdot V\)
-
\(∆U \) é a variação de energia interna do gás, medida em Joule \([J ]\).
-
p é a pressão, medida em Pascal \([Pa ]\).
-
V é o volume, medido em metros cúbicos \([m^3 ]\).
➝ Energia interna de um gás diatômico
Os gases diatômicos são aqueles que possuem dois átomos, como o hidrogênio (\(H_2\)), nitrogênio (\(N_2\)), oxigênio (\(O_2\)), monóxido de carbono (CO) e dicloro (Cl2 ). Os gases diatômicos não giram ao redor da reta que liga os dois átomos, por isso possuem cinco graus de liberdade, sendo três graus de translação e dois graus de rotação. Assim, a energia interna de um gás diatômico é dada pela fórmula:
\(∆U=\frac{5}2\cdot n\cdot R\cdot ∆T\)
-
\(∆U \) é a variação de energia interna do gás, medida em Joule \([J ]\).
-
n é o número de mols do gás, medido em \([mol ]\).
-
R é a constante universal dos gases ideais, cujo valor é \(8,31\ J/mol\cdot K\) ou \(0,082\ atm\cdot L/mol\cdot K \).
-
\(∆T \) é a variação da temperatura, medida em Kelvin \([K ]\).
➝ Energia interna de um gás poliatômico
Os gases poliatômicos são aqueles que possuem três ou mais átomos, como o dióxido de enxofre (\(SO_2\)), água (\(H_2O \)) e metano (\(CH_4 \)). Os gases poliatômicos possuem seis graus de liberdade, sendo três graus de translação e três graus de rotação. Assim, a energia interna de um gás poliatômico pode ser dada pela fórmula:
\(∆U=\frac{6}2\cdot n\cdot R\cdot ∆T\)
\(∆U=3\cdot n\cdot R\cdot ∆T\)
-
\(∆U \) é a variação de energia interna do gás, medida em Joule \([J ]\).
-
n é o número de mols do gás, medido em \([mol ]\).
-
R é a constante universal dos gases ideais, cujo valor é \(8,31\ J/mol\cdot K\) ou \(0,082\ atm\cdot L/mol\cdot K\).
-
\(∆T \) é a variação da temperatura, medida em Kelvin \([K ]\).
Leia também: Entropia — uma grandeza termodinâmica
Energia interna em transformações
De acordo com a primeira lei da Termodinâmica,
A energia interna de um sistema tende a aumentar se acrescentamos energia na forma de calor e a diminuir se removemos energia na forma de trabalho realizado pelo sistema.|1|
Então, a energia interna de um sistema fechado varia de acordo com as quantidades de energia térmica (calor) e de trabalho realizado pelo sistema em algumas transformações termodinâmicas. Em geral, a energia interna de um sistema termodinâmico é dada pela fórmula:
\(∆U=Q-W\)
-
\(∆U \) é a variação de energia interna de um sistema termodinâmico, medida em Joule \([J ]\).
-
Q é o calor transferido entre o sistema termodinâmico e a vizinhança, medido em Joule \([J ]\).
-
W é o trabalho realizado pelo ou no sistema termodinâmico, medido em Joule \([J ]\).
➝ Transformação isotérmica
A transformação isotérmica é caracterizada como uma transformação termodinâmica em que a temperatura é constante. Sendo assim, a variação de energia interna é nula, portanto o calor é todo convertido em trabalho e vice-versa, como descrito abaixo:
\(∆U=Q-W\)
\(0=Q-W\)
\(Q=W\)
-
Q é o calor transferido entre o sistema termodinâmico e a vizinhança, medido em Joule \([J ]\).
-
W é o trabalho realizado pelo ou no sistema termodinâmico, medido em Joule \([J ]\).
➝ Transformação isovolumétrica
A transformação isovolumétrica é caracterizada como uma transformação termodinâmica em que o volume é constante, impedindo a realização de trabalho, portanto a variação da energia interna varia de acordo com o calor transferido entre o sistema e o meio. Assim, a fórmula da variação da energia interna toma uma nova forma:
\(∆U=Q-W\)
\(∆U=Q-0\)
\(∆U=Q\)
-
\(∆U \) é a variação de energia interna do gás, medida em Joule \([J ]\).
-
Q é o calor transferido entre o sistema termodinâmico e a vizinhança, medido em Joule \([J ]\).
➝ Transformação isobárica
A transformação isobárica é caracterizada como uma transformação termodinâmica em que a pressão é constante, então o trabalho é dado pela fórmula:
\(W=p\cdot ∆V\)
-
W é o trabalho realizado pelo ou no sistema termodinâmico, medido em Joule \([J ]\).
-
p é a pressão do gás, medida em Pascal \([Pa ]\).
-
\(∆V\) é a variação de volume do gás, medida em metros cúbicos \([m^3 ]\).
Assim, a variação da energia interna pode ser calculada como:
\(∆U=Q-W\)
\(∆U=Q-p\cdot ∆V\)
-
\(∆U \) é a variação de energia interna do gás, medida em Joule \([J ]\).
-
Q é o calor transferido entre o sistema termodinâmico e a vizinhança, medido em Joule \([J ]\).
-
W é o trabalho realizado pelo ou no sistema termodinâmico, medido em Joule \([J ]\).
-
p é a pressão do gás, medida em Pascal \([Pa ]\).
-
\(∆V\) é a variação de volume do gás, medida em metros cúbicos \([m^3 ]\).
➝ Transformação adiabática
A transformação adiabática é caracterizada por ser tão rápida a ponto de não ocorrer troca de calor entre o sistema e o meio, portanto a variação da energia interna varia de acordo com o trabalho realizado pelo ou no sistema termodinâmico. Assim, a fórmula da variação da energia interna toma uma nova forma:
\(∆U=0-W\)
\(∆U=-W\)
-
\(∆U\) é a variação de energia interna do gás, medida em Joule \([J ]\).
-
W é o trabalho realizado pelo ou no sistema termodinâmico, medido em Joule \([J ]\).
Energia interna em processos cíclicos
A energia interna em processos cíclicos é sempre nula, já que o sistema sempre retorna ao seu estado inicial. Assim, o trabalho realizado pelo ou no sistema termodinâmico é igual ao calor transferido entre o sistema termodinâmico e o meio. Esse resultado é empregado às máquinas térmicas que têm seu funcionamento em ciclos.
Como calcular a energia interna?
Podemos calcular a energia interna por meio das suas fórmulas gerais. Então, para melhor compreender como isso funciona, vejamos alguns exemplos.
Exemplo 1: Um sistema termodinâmico inicialmente apresenta uma energia interna de 36.458 J e após a sua variação de temperatura passa a apresentar uma energia interna de 22.734 J. Considerando essas informações, calcule a variação de energia interna desse sistema.
Levando em conta as informações fornecidas pelo enunciado, utilizaremos a fórmula:
\(∆U=U_f-U_i\)
\(∆U=36 458-22 734\)
\(∆U=13 724\ J\)
Portanto, a variação da energia interna é de 13.724 Joules.
Exemplo 2: Qual é a variação da energia interna de 4 mols de um gás monoatômico que está a 400 K? Considere a constante universal dos gases ideais como \(8,31\ J/mol\cdot K \).
Considerando as informações fornecidas pelo enunciado, utilizaremos a fórmula:
\(∆U=\frac{L}2\cdot n\cdot R\cdot ∆T\)
Como se trata de um gás monoatômico, temos três graus de liberdade:
\(∆U=\frac{3}2\cdot 4\cdot 8,31\cdot 400\)
\(∆U=\frac{39 888}2\)
\(∆U=19 944\ J\)
Portanto, a variação da energia interna é de 19.944 Joules.
Exemplo 3: Calcule a variação da energia interna de 5 mols de um gás poliatômico que possui calor específico molar a volume constante igual a 3R e que varia sua temperatura de 600 K até 300 K. Considere a constante universal dos gases ideais como \(8,31\ J/mol\cdot K \).
Considerando as informações fornecidas pelo enunciado, utilizaremos a fórmula:
\(∆U = n\cdot c_v\cdot ΔT\)
\(∆U = 5\cdot 3R\cdot (600-300)\)
\(∆U = 5\cdot 3\cdot 8,31\cdot (300) \)
\(∆U = 37 395 \ J \)
Portanto, a variação da energia interna é de 37.395 Joules.
Leia também: Equilíbrio térmico — condição na qual dois ou mais corpos encontram-se à mesma temperatura
Exercícios resolvidos sobre energia interna
Questão 1
(Eear) Uma amostra de um gás ideal realiza uma sequência de transformações termodinâmicas (AB, BC, CD e DA) conforme o gráfico pressão (P) em função do volume (V) a seguir.
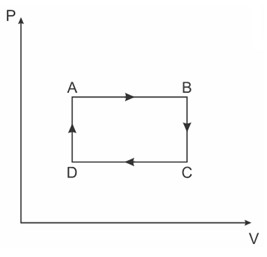
Assinale a alternativa que indica corretamente as transformações termodinâmicas pelas quais a energia interna da amostra aumentou.
a) DA e CD
b) AB e BC
c) AB e DA
d) BC e CD
Resolução:
Alternativa C
A variação da energia interna é proporcional à pressão e ao volume, então ela aumentará nos locais onde o volume e/ou a pressão aumentaram, que é o caso das transformações AB e DA.
Questão 2
Determine a energia interna em 5 mols de um gás monoatômico ideal que está a uma temperatura de –73 °C. Considere a constante universal dos gases ideais como \(8,31\ J/mol\cdot K\).
a) 14 425 J
b) 10 056 J
c) 9 586 J
d) 12 465 J
e) 20 672 J
Resolução:
Alternativa D
Primeiramente, converteremos a temperatura de Celsius para Kelvin:
\(∆T= – 73 °C+273=200 K\)
Então, para calcular a energia interna do gás, usaremos a sua fórmula:
\(∆U=\frac{3}2\cdot n\cdot R\cdot ∆T\)
\(∆U=\frac{3}2\cdot 5\cdot 8,31\cdot 200\)
\(∆U=12 465\ J\)
Notas
|1| Citação retirada do livro Fundamentos da Física: Gravitação, Ondas e Termodinâmica (vol. 2).


