Agente Redutor e Agente Oxidante

Uma reação de oxidorredução é aquela em que há transferência de elétrons; com isso uma espécie química ganha elétrons e simultaneamente outra espécie química perde elétrons.
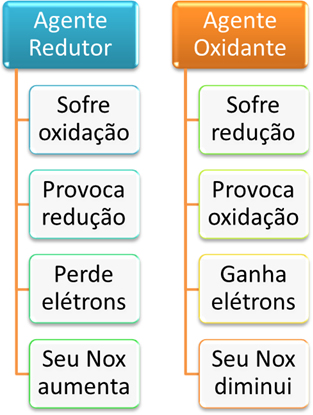
Essas reações são chamadas dessa forma porque o ganho de elétrons corresponde a uma redução, enquanto que a perda de elétrons constitui uma oxidação.
Veja o exemplo abaixo:
Fe2O3(s) + 3 CO(g) → Fe2 (s) + 3 CO2(g)
Essa reação de oxidorredução corresponde ao processo feito em fornos siderúrgicos, nos quais o minério hematita (Fe2O3(s)) reage com o monóxido de carbono (CO), obtendo-se assim o ferro metálico. A partir das variações dos números de oxidação (Nox) das espécies reagentes e dos produtos é possível verificar quem sofre redução e quem sofre oxidação:
+3 -2 +2 -2 0 +4 -2
Fe2O3(s) + 3 CO(g) → Fe2 (s) + 3 CO2(g)
Veja que o Nox do ferro diminuiu de +3 para zero. Isso significa que ele recebeu elétrons (que possuem carga negativa, por isso o valor diminui), ou seja, ele sofre uma redução. Mas, para que o ferro da hematita ganhe elétrons e reduza é necessário que outra espécie química forneça esses elétrons para ela. No caso, a substância que faz isso é o monóxido de carbono (CO).
Sabemos disso, porque o Nox do carbono aumentou de +2 para +4, isso quer dizer que ele perdeu elétrons. Portanto, visto que o CO causou a redução da hematita, então ele é considerado o agente redutor.
Podemos seguir a mesma linha de raciocínio no caso da oxidação do CO: sua oxidação foi causada por alguma espécie, que no caso foi a hematita. Desse modo, a hematita é o agente oxidante.
Resumidamente, temos:
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















