Lei de Lavoisier
A Lei de Lavoisier é uma das leis que regem as reações químicas e está baseada no princípio de conservação das massas. Em uma transformação química, em que determinadas substâncias se transformam em outras, a massa dessas substâncias não é alterada, ou seja, a massa dos reagentes é igual à massa dos produtos.
A Lei de Lavoisier pode ser verificada experimentalmente, isto é, quando se executa um experimento químico dentro de um sistema fechado, fazendo registros de massa, antes e após a reação.
Essa lei também é conhecida como Lei de Conservação das Massas e, popularmente, é enunciada pela frase: “Na natureza nada se cria, nada se perde, tudo se transforma”.
Leia também: Quais são as propriedades da matéria?
Resumo sobre a Lei de Lavoisier
-
A Lei de Lavoisier é uma das leis que regem as reações químicas, também conhecida como Lei de Conservação das Massas.
-
Segundo essa lei, a massa das substâncias envolvidas em uma reação química se mantém constante. Ou seja, a massa dos reagentes é igual à massa dos produtos.
-
Essa lei pode ser verificada quando uma reação é realizada em sistema fechado.
-
Em sistema aberto, pode haver perda de componentes da reação para a atmosfera e serem registrados valores menores de massa.
-
Popularmente, a Lei de Lavoisier pode ser descrita como: “Na natureza nada se cria, nada se perde, tudo se transforma”.
Videoaula sobre a lei de Lavoisier
O que diz a Lei de Lavoisier?
A Lei de Lavoisier também é conhecida como Lei de Conservação das Massas e tem como enunciado a frase “Na natureza nada se cria, nada se perde, tudo se transforma”.
Dentro do contexto da Química, o conceito de conservação das massas é uma das leis naturais que regem a ocorrência de reações químicas. Em uma reação química, uma ou mais substâncias reagem entre si, transformando-se em novas substâncias.
O formato da Lei de Lavoisier para as reações químicas é:
“Quando uma reação química é realizada em um recipiente fechado, a massa dos produtos é igual à massa dos reagentes”
Isso significa que a massa total de um frasco fechado não se altera quando uma reação química acontece dentro dele. Afinal, não há nada sendo perdido ou criado, os átomos apenas estão se reorganizando para formar novas substâncias.
Em termos matemáticos, podemos expressar essa lei da seguinte forma:
\(\mathbf{massa_{produtos}= massa_{reagentes}}\)
Por exemplo, para a formação da molécula de água (H2O) são necessários dois átomos de hidrogênio e um átomo de oxigênio. Simplificadamente, cada unidade de hidrogênio pesa 1 grama e cada unidade de oxigênio pesa 16 gramas. Assim, a massa da molécula de água (produto) será igual à soma das massas dos reagentes, ou seja, 18 gramas.
Nesse exemplo, houve uma transformação química, mas a massa foi conservada antes e após a reação. A ilustração abaixo representa bem isso, indicando que os mesmos átomos estão presentes antes e após a reação, apenas foram reorganizados de uma forma diferente.
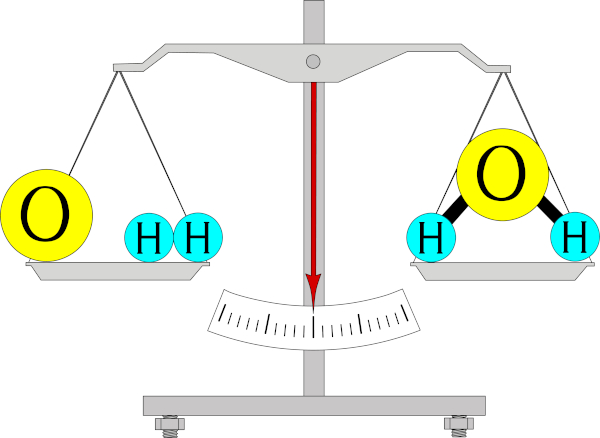
Experimento da Lei de Lavoisier
A verificação da Lei de Conservação das Massas foi efetuada experimentalmente por Lavoisier em 1785. Nessa época, sabia-se que as reações químicas de queima de algum objeto (reação de combustão) ocorriam mediante perda de massa.
Para entender melhor esse processo, o cientista optou por realizar a combustão do mercúrio em ambiente fechado, registrando cuidadosamente os valores de massa no início e no final do procedimento. No experimento, ele utilizou um aparato formado por uma retorta (frasco com gargalo estreito e curvo) preenchida com mercúrio líquido, cujo gargalo se estendia até um frasco circular de vidro (redoma) preenchido com ar e emborcado em um recipiente que também continha mercúrio.
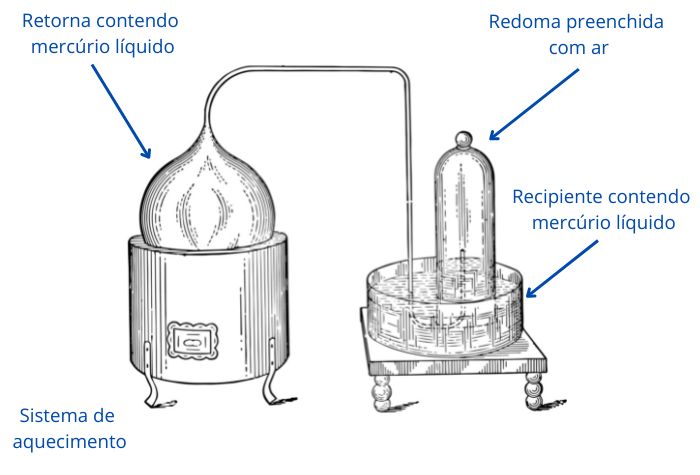
Lavoisier aqueceu o mercúrio contido na retorta, promovendo a sua calcinação (reação de combustão) e verificou que o volume de ar na redoma diminuiu, indicado pela elevação do volume ocupado pelo mercúrio. Ao mesmo tempo, formou-se no frasco um sólido de cor vermelha, que hoje se conhece como óxido de mercúrio (produto da reação).
Como o volume de ar dentro do sistema diminuiu, Lavoisier concluiu que o mercúrio líquido reagiu com algum componente presente no ar da redoma, transformando-se na nova substância (óxido de mercúrio). Em suas cuidadosas medições na balança, ele verificou que não houve nenhuma alteração de massa durante o processo.
Com base nessas informações, o cientista verificou que, quando o sistema é mantido fechado durante uma reação química, a massa das substâncias envolvidas não sofre alterações. Mas, quando uma reação ocorre em ambiente aberto e há a formação de produtos gasosos, esses gases são perdidos para a atmosfera e, aparentemente, ocorre uma diminuição da massa total.
Assim, Lavoisier conseguiu chegar à seguinte definição: as massas de reagentes e de produtos são mantidas constantes na ocorrência de uma reação em ambiente fechado, pois, nesse caso, não há escape de substâncias pelo ar.
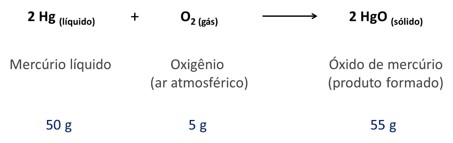
Abaixo está representada a reação química empregada por Lavoisier: Segundo a lei de conservação das massas, se 50 gramas de mercúrio reagem com 5 gramas de oxigênio do ar, o resultado será 55 gramas de óxido de mercúrio.
Alguns exemplos da Lei de Lavoisier
Como a Lei de Conservação das Massas é uma lei da natureza, ela está presente em todas as reações químicas do cotidiano.
Por exemplo, em uma fogueira:

Aparentemente, o fogo destrói toda a madeira e a massa gerada de cinzas é menor do que a massa da madeira utilizada inicialmente. No entanto, ao conhecermos a reação química de combustão da madeira, vemos que ela é transformada em cinzas, dióxido de carbono (gás carbônico) e vapor de água. Assim, se essa reação fosse repetida em um ambiente fechado (como no experimento de Lavoisier), a massa inicial dos reagentes (madeira e oxigênio) seria a mesma dos produtos (cinzas, CO2 e vapor de água). Porém, como a fogueira é acesa a céu aberto, os produtos em estado gasoso são liberados para a atmosfera e temos a impressão de que houve perda de massa no processo.
Outro exemplo interessante é a formação de ferrugem em uma peça de ferro. Suponhamos que uma peça de ferro possua massa de 15 g. Depois de deixá-la por algum tempo exposta à umidade e ao ar atmosférico, haverá a formação da ferrugem, que é a substância química hidróxido de ferro (Fe(OH)3). Ao ser realizada novamente a pesagem dessa peça, verificamos que ela possui 15,8 g, ou seja, houve um aumento do seu valor de massa. Como isso se explica? A massa foi criada?

\(\mathbf{2\ Fe\ (s)+ \frac{3}4 \ O_2\ (g)+3\ H_2 O\ (v)⟶2\ Fe(OH)_3\ (s)}\)
De acordo com a Lei de Conservação das Massas, o aparente aumento de massa da peça de ferro é justificado pela incorporação de átomos de oxigênio do ar durante a reação química de oxidação do ferro, para a formação da ferrugem. Se esse mesmo teste for executado em ambiente fechado, não haverá variação de massa entre reagentes (ferro e oxigênio do ar) e produtos (óxido de ferro).
Leia também: Qual é a diferença entre fenômenos físicos e químicos?
Lei de Proust
A Lei de Proust e a Lei de Lavoisier são conhecidas como leis ponderais e regem a ocorrência das reações químicas.
A Lei de Proust, também chamada de Lei das Proporções Constantes, postula que substâncias químicas se combinam para formar novos compostos, sempre respeitando uma proporção constante. Essa lei foi definida por Joseph Louis Proust em 1801.
Podemos ver um exemplo da aplicação dessa lei para a reação de formação do óxido de magnésio (MgO). Para formar 10 g desse produto, é necessária a combinação entre 6 g do magnésio metálico (Mg) e 4 g do gás oxigênio (O2):
\(Mg\ (s)\ \ \ \ \ \ \ \ O_2\ (g)\ \ \ \ \ \ \ \ MgO\ (s)\\ \ 6g \ \ \ \ \ \ \ \ \ \ + \ \ \ \ 4g \ \ \ ➝\ \ \ \ \ \ 10 g\)
Ao dobrar a massa de magnésio metálico, o mesmo terá que ocorrer com a massa do oxigênio, formando também o dobro de massa do produto.
|
|
\(\mathbf{Mg\ (s)}\) |
+ |
\(\mathbf{O_2\ (g)}\) |
⟶ |
\(\mathbf{MgO\ (s)}\) |
|
Experimento 1 |
6 g |
|
4 g |
|
10 g |
|
Experimento 2 |
12 g |
|
8 g |
|
20 g |
Note que, ao dividir os valores de massa do segundo experimento pelos do primeiro, o mesmo valor de proporção deve ser alcançado para cada um dos componentes, comprovando-se a Lei de Proust.
-
Para o magnésio: \(\frac{12}{6}=2\);
-
Para o gás oxigênio: \(\frac{8}{4}=2\);
-
Para o óxido de magnésio: \(\frac{20}{10}=2\);
Antoine Laurent Lavoisier
Antoine Laurent Lavoisier era francês e nasceu em 1743. Sua família era abastada e ele teve um ótimo ensino. Logo cedo, aos 22 anos, recebeu uma medalha da Academia de Ciências em razão de suas contribuições no projeto de iluminação de Paris.
Lavoisier é conhecido por suas inúmeras contribuições para a Química, e foi nomeado como “pai da química moderna”. Esse título se justifica pela abordagem extremamente precisa e cuidadosa que Lavoisier adotava em seus estudos, que envolviam medições de massa em balança, registro de todas suas ações e observações em laboratório e repetição dos experimentos.
Em 1789, Lavoisier publicou a obra intitulada “Tratado Elementar de Química”, na qual apresentava uma nova nomenclatura para os elementos químicos. O cientista também teve importante contribuição para o entendimento das reações de combustão e foi o descobridor da Lei de Conservação das Massas.
Além de cientista, ele ocupava um cargo público, sendo o arrecadador-chefe dos impostos da monarquia francesa. Também atuou na política.
Lavoisier foi guilhotinado em 1794 por, supostamente, subornar e desviar os impostos que recolhia. Na realidade, ele foi vítima de uma perseguição iniciada por Jean Paula Marat, um dos líderes da Revolução Francesa, que não aceitou o fato de ter um de seus artigos científicos recusados por Lavoisier para publicação na Academia de Ciências, órgão do qual também fazia parte.
Durante a juventude, Lavoisier se casou com Marie Anne Paulze. A esposa se tornou sua assistente nos trabalhos de pesquisa, traduzindo artigos, montando experimentos e construindo ilustrações para os artigos de Lavoisier. Com o tempo de aprendizado, ela se tornou também pesquisadora de química. Após a morte do cientista, sua esposa publicou uma obra contendo anotações e estudos do marido.

Exercícios resolvidos sobre a lei de Lavoisier
Questão 1
Hidróxido de potássio (KOH) reage prontamente com dióxido de carbono (CO2) para produzir carbonato de cálcio (CaCO3) e água (H2O). Quantos gramas de CaCO3 são produzidos se 112,2 gramas de KOH reagir com 44 gramas de CO2?
A reação também produz 18 de gramas de água.
a) 174,2 g.
b) 94,5 g.
c) 138,2 g.
d) 174,2 g.
Resolução:
Letra C.
A reação descrita no enunciado é:
\(\mathbf{KOH+ CO_2⟶CaCO_3+H_2 O}\)
Perceba que as massas dos reagentes são conhecidas:
\(\mathbf{m_{reagentes}= m_{KOH}+ m_{CO_2}=112,2+44=156,2}\)
A massa dos produtos é parcialmente conhecida:
\(\mathbf{m_{produtos}= m_{CaCO_3}+ m_{H_{2} O}= m_{CaCO_3 }+18}\)
Aplicando a Lei de Conservação das Massas, ou Lei de Lavoisier, tem-se:
\(\mathbf{m_{reagentes}= m_{produtos}}\)
\(\mathbf{156,2= m_{CaCO_3}+18 }\)
\(\mathbf{m_{CaCO_3}= 156,2-18}\)
\(\mathbf{m_{CaCO_3}=138,2 g}\)
Questão 2
(PUC-SP) Querendo verificar a Lei da Conservação das Massas (Lei de Lavoisier), um estudante realizou a experiência esquematizada abaixo:
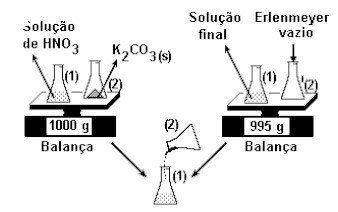
Terminada a reação, o estudante verificou que a massa final era menor do que a massa inicial. Assinale a alternativa que explica o ocorrido:
a) A Lei de Lavoisier só é válida nas condições normais de temperatura e pressão.
b) A Lei de Lavoisier não é válida para reações em solução aquosa.
c) De acordo com a Lei de Lavoisier, a massa dos produtos é igual à massa dos reagentes, quando eles se encontram na mesma fase de agregação.
d) Para que se verifique a Lei de Lavoisier, é necessário que o sistema seja fechado, o que não ocorreu na experiência realizada.
e) Houve excesso de um dos reagentes, o que invalida a Lei de Lavoisier.
Resolução:
Letra d.
Item a incorreto. A Lei de Lavoisier é válida para qualquer condição.
Item b incorreto. A Lei de Lavoisier é válida para qualquer reação.
Item c incorreto. A Lei de Lavoisier é válida para qualquer reação, independente do estado de agregação.
Item d correto. No experimento, a redução do valor de massa se explica pela formação de um produto no estado gasoso que, em razão do frasco estar aberto, foi liberado para a atmosfera e por isso não foi quantificado na pesagem.
Item e incorreto, pois mesmo havendo excesso de um dos reagentes, a sua massa será identificada na balança.

