Entalpia
A entalpia é a energia térmica envolvida em uma reação ou processo químico. Há cinco tipos de entalpia que podem ser calculados: formação, combustão, ligação, neutralização e dissolução. Esse cálculo do valor da variação de entalpia é importante para determinar se o processo é endotérmico ou exotérmico.
Leia mais: Elementos químicos – grupos de átomos com mesmo número de prótons no núcleo
O que é entalpia?
Entalpia é a energia térmica envolvida nos diferentes tipos de reações químicas, em que substâncias simples têm, por convenção, entalpia igual a zero. A variação da entalpia pode ser calculada pela subtração do valor de entalpia dos produtos pelo valor de entalpia dos reagentes, ou seja:
∆H = Hp – Hr
∆H → Variação de entalpia
Hp → Entalpia dos produtos
Hr → Entalpia dos reagentes
O resultado do cálculo de variação de entalpia determinará se estamos lidando com uma reação que libera ou absorve calor, como pode ser observado nos gráficos a seguir:
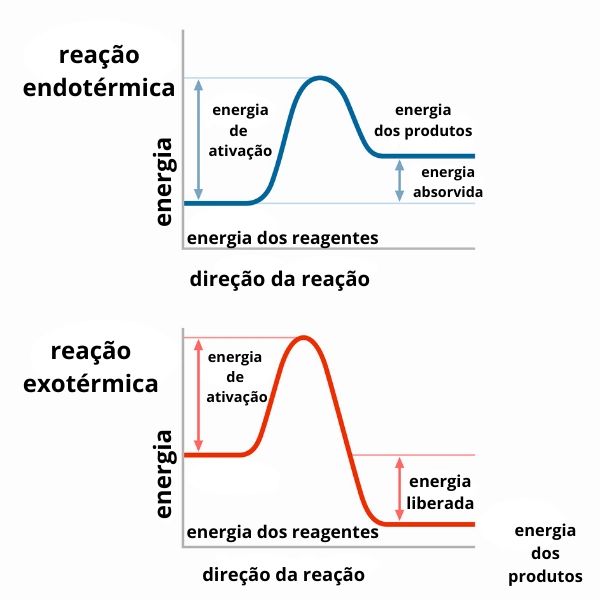
Tipos de entalpia
-
Entalpia de formação
É a variação de energia térmica envolvida na formação de um mol de uma substância qualquer, sendo ela formada com base em substâncias simples ou no estado fundamental, como no exemplo a seguir:
1/2H2 + O2 = H2O
→ Note que os reagentes são ambos substâncias simples, ou seja, têm entalpia igual a 0, e que o valor de entalpia da água (H2O) é predeterminado em laboratório, sendo, portanto, um dado fornecido, logo, o calculo da variação de entalpia fica da seguinte forma:
∆H = Hp – Hr
∆H = ( - 68,4 ) - (1/2.0 + 0)
∆H = -68,4 → Reação exotérmica
→ Perceba que temos um resultado menor que 0, isso significa que, nessa reação de formação de um mol de H2O, teremos liberação de energia.
-
Entalpia de combustão
É a variação aferida de calor para que haja a combustão de 1 mol de uma substância qualquer. Toda reação de combustão terá valor de variação de entalpia menor que zero, pois se trata de uma reação que libera calor.
-
Exemplo
Reação e valor da variação de entalpia para a reação de combustão do etanol:
C2H6O(l) + 3.O2(g) → 2 CO2(g) + 3 H2O(l) ΔH = -326 Kcal/mol
A seguir, valores de entalpia de combustão para algumas substâncias comuns:
-
Etanol gasoso (C2H6)= -372,8 Kcal/mol
-
Benzeno líquido (C6H6) = -781,0 Kcal/mol
-
Sacarose sólida ( C12 H22O 11) = -1348,9 Kcal/mol
-
Entalpia de ligação
É a energia necessária para romper-se um mol de uma ligação química. A variação de energia nesse caso sempre resulta em um valor maior que 0, ou seja, a quebra de ligações demanda absorção de calor.
-
Exemplo
CH4(g)+C(g)+4H(g) ΔH = +1.651,6 kJ/mol
C – H → C(g) + H(g) ΔH = +412,9 KJ/ mol
Cl – Cl → Cl(g) + Cl (g) ΔH = +242,0 KJ/mol
-
Entalpia de neutralização
É a variação de energia em reações de neutralização, como a neutralização de ácido base:
Ácido + base = sal + água → exotérmica
Assim como nos demais casos de entalpia, para os valores de neutralização, deve-se considerar os cálculos para 1mol. Nesse caso, o valor final da variação de entalpia será, para a reação de neutralização, de 1 mol de H+ para 1 mol de OH-
Acesse também: Reação de neutralização total: como ocorre?
-
Entalpia de dissolução
É a variação de energia térmica envolvida na dissolução de um mol de determinado soluto em uma quantidade “x” de água ou outro solvente qualquer, desde que haja solubilização completa e torne-se uma mistura homogênea.
-
Exemplo
NaCl(s) + aq → Na+(aq) + Cl-(aq) ∆H = -0,9 Kcalmol
Na reação, podemos ver quimicamente a dissolução do hidróxido de sódio, popularmente conhecido como soda cáustica, em meio aquoso. Perceba que a reação tem uma variação de entalpia menor que zero, o que significa que há liberação de calor. Essa reação é comumente realizada na fabricação de sabão caseiro, processo que, quando não feito sob os devidos cuidados, pode resultar em acidente com queimaduras de até 3° grau.
Resumo:
-
Entalpia: variação de energia térmica envolvida em uma reação química.
-
Variação de entalpia final determina se a reação é exotérmica ou endotérmica: ΔH > 0 (endotérmica); ΔH < 0 (exotérmica).
-
Tipos de entalpia: formação, combustão, ligação, neutralização e dissolução.
Acesse também: Como calcular a variação da entalpia por meio da lei de Hess?
Exercícios resolvidos
Questão 1 - (PUC - 2016) A entalpia de combustão do carbono, a 25 °C, é de 393,5KJ/mol. Considerando-se 1,0 kg de turfa — um tipo de carvão mineral que contém somente 60% de carbono —, em média, a energia liberada, em kJ, somente pela queima de carbono é de, aproximadamente:
a) 2000
b) 5000
c) 10 000
d) 15 000
e) 20 000
Dado: Massa molar do carbono: 12g/mol
Resolução
Alternativa E.
1° passo: Se para 1 Kg temos que 60% representam a massa do carbono, portanto, 60% de 1Kg = 600g de carbono.
2° passo: Calculamos agora quantos mols teremos em 600g de carbono. Sabendo que a massa molar do carbono é 12 g/mol, podemos estabelecer a seguinte relação:
12 g ----- 1 mol
600 g ------- x mol
x = 50 mol
3° passo: Estabelecendo-se agora uma relação de energia para cada mol de matéria em combustão:
393,5 KJ/mol ----------- 1 mol
x KJ/mol ---------------- 50 mol
x = 19675,0 (aproximadamente 20 000)
Questão 2 - (Unicamp - 2018) O livro O pequeno príncipe, de Antoine de Saint-Exupéry, uma das obras literárias mais traduzidas no mundo, traz ilustrações inspiradas na experiência do autor como aviador no norte da África. Uma delas, a figura (a), parece representar um chapéu ou um elefante engolido por uma jiboia, dependendo de quem a interpreta.
Para um químico, no entanto, essa figura pode assemelhar-se a um diagrama de entalpia, em função da coordenada da reação (figura b). Se a comparação for válida, a variação de entalpia dessa reação seria
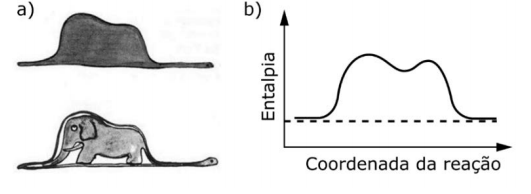
a) praticamente nula, com a formação de dois produtos.
b) altamente exotérmica, com a formação de dois produtos.
c) altamente exotérmica, mas nada se poderia afirmar sobre a quantidade de espécies no produto.
d) praticamente nula, mas nada se poderia afirmar sobre a quantidade de espécies no produto.
Resolução
Alternativa D. Observando o gráfico da figura b, em que a linha de movimentação da variação de energia aponta que a energia no início e no fim da reação é igual, podemos deduzir que o ΔH (variação da entalpia) da reação será zero ou práticamente zero. No entanto, como não temos a equação da reação descrita, nada pode ser dito em relação a quantos produtos ou reagentes estão envolvidos.
