Alotropia do Carbono
O fato de a grafite e o diamante terem o mesmo elemento (carbono) como constituinte pode causar dúvidas como: por que materiais que possuem a mesma constituição atômica são tão diferentes na consistência?
Enquanto a grafite risca suaves traços no papel, o diamante perfura dentes. As brocas usadas pelos dentistas são diamantadas, ou seja, são recobertas por diamantes. Para se ter ideia da dureza do diamante, ele é utilizado para cortar blocos de granito.
A Alotropia é o conceito que explica por que os átomos de Carbono podem se unir de várias formas diferentes formando inúmeras substâncias.
O diamante e a grafite são alótropos do carbono e se diferem pelo arranjo geométrico:
- A grafite de que estamos falando é aquele sólido macio e cinza presente na ponta do lápis, que possui densidade = 2,25 g/cm3.
- O diamante é transparente (com brilho característico) e duro. Sua densidade é 3,51 g/cm3.
Vejamos as estruturas moleculares dos alótropos do carbono:
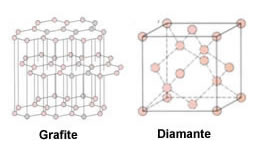
As duas formas são substâncias simples formadas apenas por carbono, mas que devido ao rearranjo dos átomos se transformam em substâncias com propriedades completamente diferentes. É o que chamamos de rearranjo dos átomos.
Veja mais!
Estudo do carbono