Oxidorredução
Oxidorredução ou oxirredução refere-se ao processo em que há transferência de elétrons entre espécies químicas (átomos e/ou íons) de substâncias que reagem entre si. Essa palavra é a junção de “oxidação + redução”, que são processos opostos, mas complementares, ou seja, um sempre depende do outro para ocorrer.
A oxidação ocorre quando o átomo perde elétrons. Visto que os elétrons são partículas negativas, a carga elétrica (Número de oxidação – Nox) da espécie que perdeu elétrons aumenta, “fica mais positiva”, por assim dizer.
Já a redução corresponde ao processo inverso, ou seja, a espécie química ganha elétrons e fica com o Nox menor, “mais negativo”.
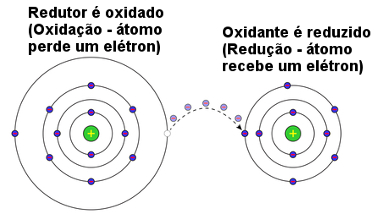
A reação de oxidorredução ocorre com transferência de elétrons
A espécie química que ganha elétrons recebe-os da espécie química que os perdeu e vice-versa. Por isso, dizemos que sempre que ocorre uma redução, ocorre também uma oxidação, e é também por isso que chamamos esses processos de reações de oxidorredução.
Além disso, se uma substância oxidou, é porque a outra espécie química ocasionou isso por retirar os elétrons dela. Assim, dizemos que a substância que contém o átomo que ganhou os elétrons ou reduziu é o agente oxidante, porque ela causou a oxidação do átomo ou íon da outra substância reagente.
Por outro lado, a substância que contém o átomo que forneceu os elétrons, isto é, que oxidou, é o agente redutor, porque ele causou a redução da outra espécie química.
Resumidamente, temos:
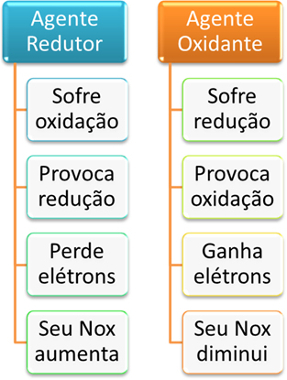
Resumo de determinação de agente redutor e agente oxidante
Vejamos um exemplo de reação de oxidorredução para visualizar melhor esses conceitos mencionados até agora. A reação de fotossíntese realizada pelas plantas para produzir seu próprio alimento e limpar o ar que respiramos é um dos processos químicos mais importantes da natureza e trata-se de uma reação de oxidorredução.
Conforme pode ser visto por meio da equação a seguir, de forma resumida, a planta retira do solo apenas água (H2O) através da raiz para que, juntamente ao gás carbônico (CO2) absorvido pelas folhas e na presença de luz, seja capaz de produzir moléculas orgânicas, como a glicose e também o gás oxigênio:
+4 -2 +1 -2 +4 -1 -2 0
6 CO2(g) + 6 H2O(l) → C6H12O6(aq) + 6 O2(g)
Essa equação química já está balanceada e acima de cada elemento foram colocados os valores dos Nox para você observar o que aconteceu. Veja que no primeiro membro da equação o Nox do átomo de oxigênio era igual a -2, mas, no segundo membro, esse Nox aumentou para zero. Isso significa que o oxigênio foi a espécie química que sofreu oxidação, ou seja, perdeu elétrons, e o dióxido de carbono (CO2) foi o agente redutor.
Por outro lado, o Nox do hidrogênio da água (H2O) era +1 e passou para -1 na molécula de glicose (C6H12O6). Visto que seu Nox diminuiu, isso significa que o hidrogênio foi o elemento que sofreu redução, ou seja, ganhou elétrons, e a água foi o agente oxidante.
É importante lembrar que em toda reação de oxirredução que estiver devidamente balanceada, a quantidade de elétrons ganhos será a mesma de elétrons perdidos.
Para saber realizar o balanceamento desse tipo de reação e para aprender a determinar o Nox dos átomos, leia os textos: Balanceamento de reações de oxidorredução e Número de Oxidação (Nox) .

