Conceito de ácido, base e sal pela teoria de Arrhenius
Ao realizar algumas experiências na Universidade de Uppsala (Suécia), o cientista Arrhenius descobriu que algumas substâncias sofrem ionização no meio aquoso e outras não. Isso significa que alguns compostos, como por exemplo, os iônicos, geram íons (partículas carregadas) quando dissolvidos na água. Isso faz com que essa solução iônica conduza corrente elétrica.
Já com outros compostos não ocorre o mesmo. O açúcar, por exemplo, é um composto molecular de fórmula: C12H22O11 e ao ser dissolvido na água não origina íons. Torna-se, então, uma solução molecular, que não conduz eletricidade.
No entanto, Arrhenius não concluiu que todas as substâncias moleculares não podem sofrer dissociação iônica, pois em um de seus experimentos ele viu que o HCl, que é um composto molecular, reage com a água formando íons positivos e negativos, conforme mostrado abaixo.
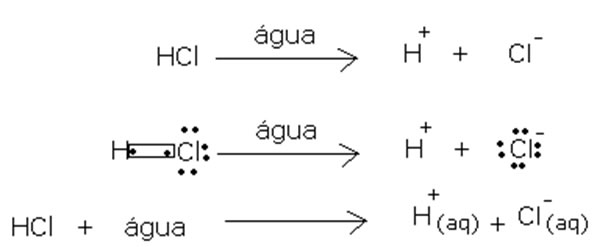
Equação química da ionização do ácido clorídrico na água
.jpg)
Quando há íons na solução aquosa, ocorre a passagem de corrente elétrica
Observando esses seus experimentos, que foram cuidadosamente repetidos e analisados, Arrhenius concluiu que algumas características se repetiam em alguns compostos e elaborou as seguintes definições para os ácidos, bases e sais:
Definição de ácido de Arrhenius: Ácidos são compostos que em solução aquosa se ionizam, produzindo como íon positivo apenas o cátion hidrogênio (H+).
Exemplo: HNO3 → H+ + NO3-
Definição de base de Arrhenius: Bases são compostos que em solução aquosa sofrem dissociação iônica, liberando como único íon negativo o ânion hidróxido (OH-), ou oxidrila ou hidroxila.
Exemplo: NaOH → Na+ + OH-
Definição de sal de Arrhenius: Sais são compostos iônicos que possuem, pelo menos, um cátion diferente de H+ e um ânion diferente de OH-.
Exemplo: NaCl (sal de cozinha) → Na+ + Cl-