Eletrólise do Cloreto de Sódio
A eletrólise é um processo em que se passa uma corrente elétrica sobre uma substância e, por meio de reações de oxirredução, o composto decompõe-se. Se a substância estiver no estado líquido (fundida), temos uma eletrólise ígnea, mas se estiver em solução aquosa, temos uma eletrólise em meio aquoso.
Uma das eletrólises de maior importância comercial é a do cloreto de sódio (NaCl), o sal de cozinha. Vejamos como ocorrem a eletrólise ígnea do cloreto de sódio e, posteriormente, a sua eletrólise aquosa.
* Eletrólise ígnea do cloreto de sódio:
A eletrólise ígnea do sal produz o gás cloro (Cl2) e o sódio metálico (Na), substâncias que não são encontradas na natureza nessa forma. O sal funde-se a uma temperatura aproximada de 800ºC e, no estado líquido, o NaCl sofre disssociação, produzindo os seguintes íons:
NaCl → Na+ + Cl-
Na eletrólise ocorre a passagem da corrente elétrica segundo o esquema a seguir:
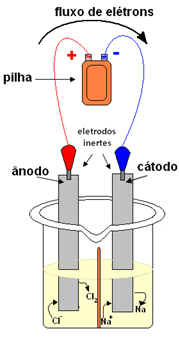
Esquema de processo de eletrólise ígnea do cloreto de sódio (sal de cozinha)
O polo negativo da bateria fornece elétrons para um dos eletrodos, que se torna o cátodo ou polo negativo. Visto que ele é negativo, ele atrai os cátions Na+ que estão no líquido. Esses íons recebem os elétrons do cátodo e, nesse eletrodo, ocorre a seguinte semirreação de redução:
Semirreação no cátodo: redução: Na+(l) + e- → Na(s)
Nesse eletrodo foi formado o primeiro produto, que é o sódio metálico.
Por outro lado, o outro eletrodo torna-se o ânodo, pois está carregado positivamente, atraindo os ânions Cl-, que perderão seus elétrons, sofrendo oxidação:
Semirreação no ânodo: oxidação: 2Cl-(l) → 2 e- + 1Cl2(g)
Esse gás cloro fica borbulhando ao redor do ânodo, como mostra a reação a seguir. Ele é coletado por meio de um tubo de vidro adaptado ao sistema:
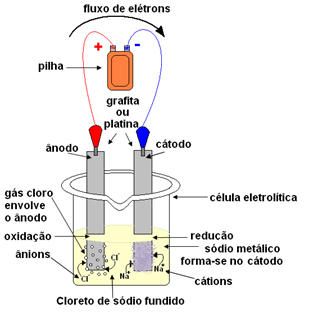
Esquema de processo de eletrólise do cloreto de sódio (sal de cozinha)
Assim, a reação global da eletrólise ígnea do sal é:
Cátodo: Na+(l) + e- → Na(s)
Ânodo: 2Cl-(l) → 2 e- + 1Cl2(g)____________
Reação Global: Na+(l) + 2Cl-(l) → Na(s) + 1Cl2(g)

Gás cloro e sódio metálico – produtos da eletrólise ígnea do sal de cozinha
* Eletrólise aquosa do cloreto de sódio:
Nesse caso, além da dissociação iônica do NaCl, formando os íons Na+ e Cl-, existe também a reação de autoionização da água, conforme a equação a seguir:
2 H2O(l)→ 1 H3O+(aq) + OH1-(aq)
Então, surgem as dúvidas: Qual cátion será descarregado primeiro no cátodo, o Na+ ou o H3O+? E no ânodo, o Cl- ou o OH- será descarregado primeiro?
Basicamente, podemos dizer que o íon menos reativo será o que descarregará em cada eletrodo.
O texto Eletrólise em meio aquoso explica detalhadamente como verificar qual é o cátion ou o ânion menos reativo e determinar como ocorre a eletrólise.
Entre o Na+ e o H3O+, o Na+ é um metal alcalino, sendo mais reativo. Por isso, a água recebe os elétrons do cátodo:
Semirreação no cátodo: 2 H+ + 2e- → H2
Agora, no caso dos ânions, o Cl- é menos reativo que o OH- e, por isso, sofre oxidação:
Semirreação no ânodo: 2 Cl- → Cl2 + 2e-
Veja a reação global dessa eletrólise:
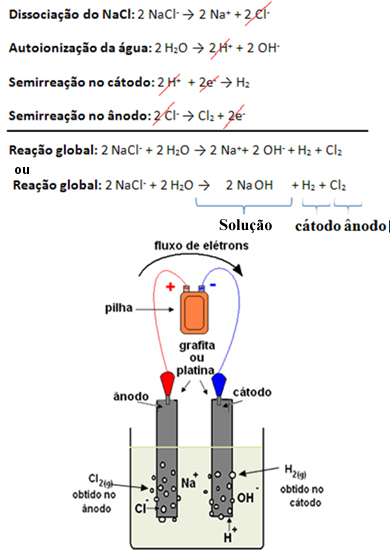
Esquema de processo de eletrólise da salmoura e reação global
Observe que a eletrólise de uma solução aquosa de NaCl produz soda cáustica (NaOH), gás hidrogênio (H2) e gás cloro (Cl2). Em virtude da presença da base NaOH, o meio permanece básico.

