Equilíbrio Químico na Ingestão de Remédios

No cotidiano temos vários exemplos de reações que se encontram em equilíbrio químico, isto é, aquelas em que a taxa de desenvolvimento da reação direta é igual à taxa de desenvolvimento da reação inversa.
Um exemplo que podemos citar ocorre em nosso estômago no momento em que ingerimos remédios. Veja o caso da Aspirina®, medicamento indicado como analgésico, cuja fórmula estrutural está representada a seguir:

Esse composto químico é um ácido carboxílico, cujo nome é ácido acetilsalicílico (AAS). Visto que é um ácido, ele sofre ionização em meio aquoso. Assim, quando ingerimos o AAS com um pouco de água, ele estabelece o seguinte equilíbrio químico:
AAS(s) + H2O(l) ↔ AAS1-(aq) + H3O1+ (aq)
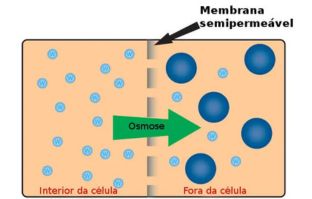
Dessa forma ionizada, a Aspirina® não consegue atravessar a camada protetora das paredes do estômago.
No entanto, é muito perigoso uma pessoa tomar esse medicamento sem prescrição médica, porque o nosso estômago é um meio muito ácido, o que desloca o sentido da reação.
Segundo o Princípio de Le Chatelier , quando se aplica uma força em um sistema em equilíbrio, ele tende a se deslocar no sentido de diminuir os efeitos dessa força. Assim, no caso da reação em equilíbrio que estamos considerando, um meio ácido iria adicionar íons H3O1+ (aq) à reação, e, imediatamente, ocorreria o aumento da concentração desses íons. Para se reajustar o equilíbrio seria deslocado para a esquerda, ou seja, a taxa de desenvolvimento da reação inversa iria aumentar, deslocando no sentido do consumo desses íons, reconstituindo a forma neutra da Aspirina®.
Na forma neutra, a Aspirina® pode atravessar a camada protetora das paredes do estômago, podendo levar a casos de hemorragia, o que é perigoso. Por isso, nunca tome medicamento sem prescrição médica.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias