Fósforo branco
O fósforo branco é uma forma alotrópica do elemento químico fósforo (P) e é composto por moléculas de P4, em que quatro átomos de fósforo se organizam de forma tetraédrica. Além disso, é conhecido por sua alta toxicidade e notável capacidade de inflamar espontaneamente quando exposto ao oxigênio do ar. Nesse sentido, essa substância se destaca por sua estrutura molecular única, aparência cerosa e reatividade excepcional.
Historicamente, o fósforo branco foi usado em diversas aplicações militares, como munições incendiárias, bem como em pirotecnia e na fabricação de palitos de fósforo. No entanto, devido aos seus graves riscos à saúde e ao meio ambiente, o uso do fósforo branco é altamente regulamentado e restrito em muitos países.
Leia também: Quais são as formas alotrópicas do fósforo?
Resumo sobre o fósforo branco
- O fósforo branco é uma das formas alotrópicas do elemento químico fósforo (P) e é caracterizado por sua estrutura molecular de P4.
- Tem a aparência de uma substância sólida cerosa, muitas vezes comparada à cera branca ou cera de abelha.
- É altamente tóxico para os seres humanos, podendo causar queimaduras graves na pele, problemas respiratórios e outros danos à saúde.
- É altamente reativo e inflama espontaneamente quando exposto ao oxigênio do ar.
- Tem um ponto de fusão relativamente baixo (cerca de 44,1 °C) e é sólido em temperatura ambiente.
- Foi historicamente usado em munições incendiárias, como granadas e bombas incendiárias, bem como em palitos de fósforo e pirotecnia.
- Devido aos riscos à saúde e ao meio ambiente, o uso do fósforo branco é amplamente regulamentado e restrito em muitos países.
- As aplicações do fósforo branco na sociedade atual são extremamente limitadas, com seu uso preferencial em contextos altamente especializados e controlados, como fogos de artifício.
- O fósforo branco e o fósforo vermelho são formas alotrópicas do elemento químico fósforo, e apresentam diferenças significativas em termos de estrutura, propriedades e aplicações.
O que é o fósforo branco?
O fósforo branco é uma forma alotrópica do elemento químico fósforo (P). Trata-se de uma substância muito reativa e altamente tóxica, conhecida por seu uso em aplicações militares e industriais.
Qual a composição do fósforo branco?
A composição química do fósforo branco é relativamente simples, uma vez que ele é formado por átomos de fósforo em sua forma alotrópica. Nesse sentido, a fórmula química do fósforo branco é P4, o que significa que ele consiste em moléculas que contêm quatro átomos de fósforo ligados covalentemente em um arranjo tetraédrico. Sendo assim, cada átomo de fósforo está ligado a outros três átomos de fósforo na molécula, conforme pode ser visto na imagem a seguir:
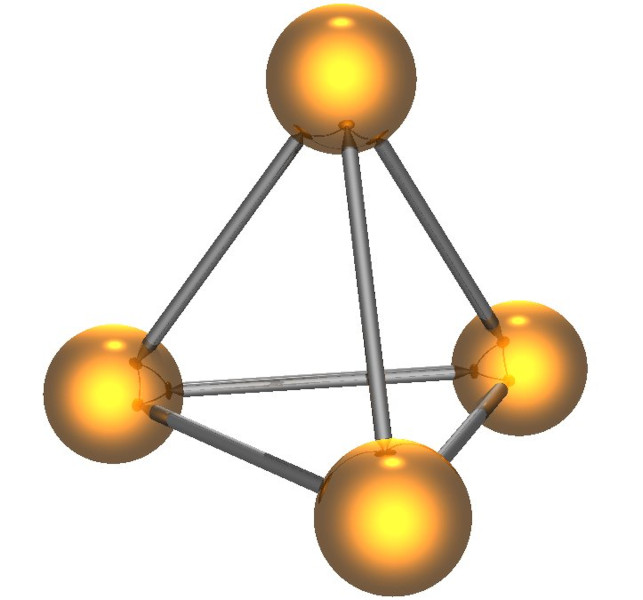
Vale destacar que o fósforo branco pode ser obtido do fósforo vermelho, outra forma alotrópica do fósforo, por meio da chamada transformação do fósforo. Para fazer essa conversão, o fósforo vermelho é aquecido em uma temperatura de cerca de 300 °C, em uma atmosfera de inertes (como nitrogênio), para evitar a combustão do fósforo.
Aplicações do fósforo branco
O fósforo branco é raramente utilizado atualmente devido à sua alta toxicidade e reatividade. Devido aos riscos associados à exposição a essa substância, suas aplicações foram amplamente descontinuadas. Todavia, ainda existem algumas aplicações extremamente limitadas em setores altamente especializados:
- Pirotecnia: o fósforo branco é utilizado em pirotecnia para criar efeitos especiais de luz, como fogos de artifício brancos intensos. No entanto, seu uso é restrito e regulamentado devido aos riscos à saúde e ao meio ambiente.
- Indústria metalúrgica: em certas aplicações metalúrgicas muito específicas, o fósforo branco pode ser usado como um agente redutor em processos de produção de metais, como o processo Pidgeon (produção de magnésio metálico).
- Pesquisa científica: em laboratórios de pesquisa, o fósforo branco pode ser usado para fins específicos, mas apenas com medidas rigorosas de segurança.
Em muitos casos, alternativas mais seguras e estáveis de fósforo, como fósforo vermelho, fosfatos e compostos fosforados, são preferidas para evitar os riscos associados ao fósforo branco.
Usos do fósforo branco na guerra

O uso do fósforo branco na guerra é uma parte sombria da história militar, em que essa substância foi empregada em munições incendiárias para causar danos devastadores a pessoas e materiais inimigos. Neste tópico veremos algumas de aplicações do fósforo branco dentro desse contexto, uma vez que ele foi usado em várias guerras ao longo do século XX e em conflitos posteriores.
- Bombas de fósforo branco: muitas vezes referidas como bombas de fósforo incendiárias, foram muito usadas em ataques aéreos durante conflitos. Logo quando essas bombas explodem, liberam uma grande quantidade de fósforo branco que se espalha sobre uma área, causando incêndios e ferindo ou matando qualquer pessoa que esteja na zona de impacto. Elas foram historicamente usadas em conflitos armados para criar incêndios e causar danos devastadores. Seu mecanismo de ação envolve as seguintes etapas:
- A bomba é lançada por aeronaves ou outros meios, e, quando atinge o alvo, ocorre uma explosão.
- Isso resulta na ruptura da cápsula de dispersão, que contém o fósforo branco.
- Após a explosão, o fósforo branco é dispersado na forma de partículas incandescentes que, ao entrarem em contato com o oxigênio do ar, se inflamam imediatamente devido à sua alta reatividade. Nesse momento, uma chama branca intensa é produzida, liberando uma grande quantidade de calor.
- Foguetes de fósforo branco: alguns foguetes militares foram equipados com ogivas de fósforo branco para fins incendiários. Quando disparados, os foguetes liberavam o fósforo branco, que então se dispersava e incendiava a área alvo.
- Finalidades de camuflagem: além dos efeitos letais, o fósforo branco era usado em alguns casos para obscurecer posições inimigas, criando cortinas de fumaça densa quando queimado, o que dificultava a visibilidade do inimigo.
- Granadas de fósforo branco: uma das aplicações mais conhecidas desse material na guerra foi em granadas incendiárias que continham essa substância. Essas granadas eram projetadas para explodir e espalhar fragmentos incandescentes de fósforo branco sobre o campo de batalha. Vale lembrar que o P4 reage com o oxigênio do ar, produzindo uma chama branca extremamente quente que adere à pele, aos uniformes e equipamentos do inimigo, causando queimaduras graves e potencialmente letais.
Importante: O uso do fósforo branco em conflitos levantou sérias preocupações éticas e humanitárias, pois ele é altamente tóxico e pode causar queimaduras graves e morte. Além disso, os feridos por essa substância muitas vezes enfrentam dificuldades significativas de tratamento médico. Em resposta a essas preocupações, tratados e convenções internacionais, como a Convenção sobre Armas Convencionais e o Protocolo III sobre Munições Incendiárias, impuseram restrições ao uso de fósforo branco em conflitos armados. No entanto, é importante observar que, embora essas restrições tenham sido implementadas, a utilização de fósforo branco em zonas de conflito ainda ocorreu em alguns casos, o que levanta preocupações contínuas sobre o respeito às normas internacionais e aos Direitos Humanos em situações de guerra.
Veja também: Armas nucleares — dispositivos que liberaram enormes quantidades de energia de maneira explosiva
Efeitos da exposição ao fósforo branco
Alguns dos efeitos devastadores da exposição ao fósforo branco são os seguintes:
- Queimaduras: o fósforo branco incandescente adere à pele, aos uniformes e equipamentos, causando queimaduras graves. Essas queimaduras são extremamente dolorosas e podem ser fatais, dependendo da extensão das lesões.
- Dificuldade de extinção: o fósforo branco é notoriamente difícil de apagar, mesmo que uma pessoa afetada role no chão ou tente apagar as chamas com água, elas continuarão queimando até que todo o fósforo seja consumido, o que pode levar a danos severos.
- Incapacitação e mortalidade: além das queimaduras, a inalação de fumaça do P4 também pode ser fatal, pois a exposição a essa substância tóxica pode levar a danos pulmonares e outros efeitos adversos à saúde.
- Danos aos pulmões: a queima dessa substância libera vapores tóxicos e fumaça, logo, a inalação desses vapores pode causar danos aos pulmões, levando a dificuldades respiratórias, inflamação pulmonar e pneumonia química.
- Intoxicação: essa substância é altamente tóxica para o sistema gastrointestinal e pode causar danos a estômago, intestinos, fígado e rins, afetando a capacidade desses órgãos de realizarem suas funções. Além disso, pode interferir no funcionamento do sistema circulatório, causando distúrbios na coagulação do sangue, e, em casos graves de exposição, podem ocorrer sintomas neurológicos, como confusão, convulsões e danos ao sistema nervoso central.
Diante disso, é importante notar que a exposição ao fósforo branco requer atenção médica imediata. Nesse sentido, o tratamento médico precoce é crucial para minimizar os danos à saúde e aumentar as chances de recuperação. Os procedimentos podem incluir a remoção do fósforo branco da área afetada, terapias para tratar queimaduras, administração de agentes quelantes para remover o fósforo do corpo, e cuidados de suporte, como tratamento de problemas respiratórios e monitoramento dos órgãos vitais.
Fósforo branco x fósforo vermelho
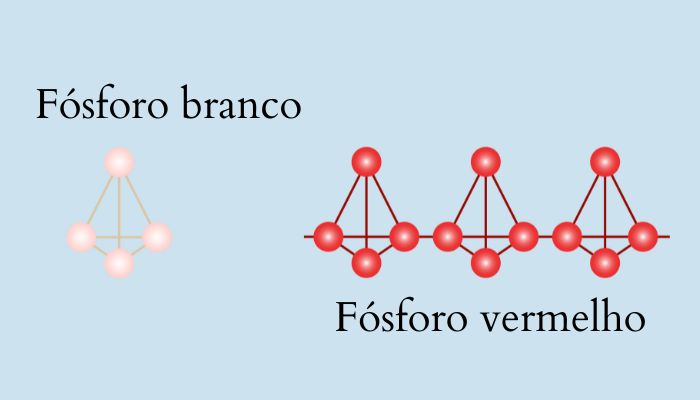
O fósforo branco e o fósforo vermelho são duas formas alotrópicas do elemento químico fósforo, e eles apresentam diferenças significativas em termos de estrutura, propriedades e aplicações. Abaixo estão as principais diferenças entre o fósforo branco e o fósforo vermelho:
|
|
Fósforo branco |
Fósforo vermelho |
|
Estrutura molecular |
É composto por moléculas de P4, em que quatro átomos de fósforo estão dispostos tetraedralmente em uma estrutura cíclica. Cada átomo de fósforo é ligado a outros três átomos. |
É uma forma polimérica do fósforo, em que os átomos de fósforo formam uma rede tridimensional. |
|
Aparência |
Tem a aparência de uma substância sólida cerosa, muitas vezes comparada à cera branca ou cera de abelha. |
Tem coloração do vermelho ao marrom e uma aparência opaca, sendo frequentemente descrito como um pó. |
|
Reatividade |
É altamente reativo e pode inflamar espontaneamente quando exposto ao oxigênio do ar. Além disso, é tóxico e pode causar queimaduras graves. |
É menos reativo e não inflama espontaneamente quando exposto ao ar. É considerado menos tóxico do que o fósforo branco. |
|
Propriedades físicas |
Tem ponto de fusão de cerca de 44,1°C e é sólido em temperatura ambiente. |
Tem ponto de fusão de cerca de 597 °C e é encontrado em várias formas alotrópicas, incluindo fósforo preto e violeta. |
|
Aplicações |
Foi historicamente usado em munições incendiárias, como granadas e bombas incendiárias, bem como em palitos de fósforo, pirotecnia e produtos químicos de laboratório. |
É usado em algumas aplicações mais seguras, como na produção de fósforos de segurança (não tóxicos), pigmentos, medicamentos, produtos químicos de laboratório, e como aditivo de fogo em alguns compostos. |
Crédito de imagem
[1]BXXXD / Wikimedia Commons (reprodução)
Fontes
ASHLEY, K.; CORDELL, D.; MAVINIC, D. A brief history of phosphorus: From the philosopher’s stone to nutrient recovery and reuse. Chemosphere, v. 84, n. 6, p. 737–746, 2011.
BERNDTSON, A. E. et al. White phosphorus burns and arsenic inhalation: A toxic combination. Journal of Burn Care and Research, v. 35, n. 2, p. 128–131, 2014.
GLEASON, W. An introduction to phosphorus: History, production, and application. Jom, v. 59, n. 6, p. 17–19, 2007.
MACLEOD, I. J.; ROGERS, A. P. V. The use of white phosphorus and the law of war. Yearbook of International Humanitarian Law, v. 10, n. 2007, p. 75–97, 2007.
MCLEAN, A. D. Burns and military clothing. Journal of the Royal Army Medical Corps, v. 147, n. 1, p. 97–106, 2001.
MOJABI, S. M. et al. Environmental impact of white phosphorus weapons on urabn areas. ICEEA 2010 - 2010 International Conference on Environmental Engineering and Applications, Proceedings, n. Iceea, p. 112–116, 2010.
PREUSS-WÖSSNER, J. et al. Contaminated sites from the war—burns due to white phosphorus. Rechtsmedizin, v. 30, n. 1, p. 31–37, 2020.
SERRANO-RUIZ, M.; ROMEROSA, A.; LORENZO-LUIS, P. Elemental phosphorus and electromagnetic radiation. European Journal of Inorganic Chemistry, n. 10, p. 1587–1598, 2014.


