Átomo
O átomo é a estrutura básica de construção da matéria, sendo a menor porção de um elemento químico que mantém sua identidade e propriedades. A teoria atômica moderna considera que o átomo é composto por duas regiões: o núcleo, que reúne os prótons e os nêutrons e mantém carga elétrica positiva, e a eletrosfera, região ao redor do núcleo formada por um grande espaço vazio e habitada pelos elétrons, partículas de carga elétrica negativa.
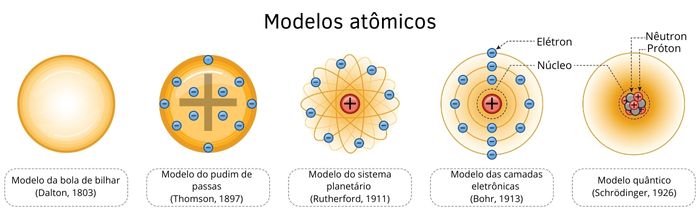
A construção do conceito de átomo pode ser verificada analisando a evolução dos modelos atômicos, os quais foram consequências de resultados experimentais. O primeiro deles, o modelo de Dalton, assumia o átomo com uma esfera indivisível. Na sequência, foram sendo descobertas as partículas subatômicas e os níveis de energia, até que se chegasse à avançada interpretação quântica de Schrödinger para as regiões da eletrosfera.
Veja também: Atomística — a área de estudo responsável pelo estudo do átomo
Resumo sobre átomo
-
O átomo é a unidade básica de construção da matéria.
-
É a menor porção de um elemento químico que mantém sua identidade.
-
Duas regiões constituem o átomo: núcleo e eletrosfera.
-
O núcleo é denso e possui massa, concentrando prótons e nêutrons.
-
A eletrosfera é um amplo espaço vazio em que habitam os elétrons.
-
O átomo é formado por outras partículas subatômicas, além de prótons, elétrons e nêutrons.
-
O número atômico, o número de massa, o tamanho e a estabilidade do núcleo são algumas das propriedades dos átomos.
-
Alguns átomos podem formar agrupamentos em razão de similaridades químicas.
-
Alguns átomos do mesmo elemento possuem massas atômicas diferentes e são chamados de isótopos.
-
Alguns átomos possuem números de massa iguais, mas são elementos diferentes, sendo isóbaros entre si.
-
Átomos que se assemelham apenas pela quantidade de nêutrons, mas que mantêm número atômico e de massa distintos, são chamados isótonos.
-
A evolução dos modelos atômicos permite entender como ocorreu a construção do conceito de átomo e sua descoberta, por meio de experimentos de laboratório.
O que é um átomo?
O átomo é o bloco fundamental de construção da matéria, sendo a menor fração de um elemento químico capaz de manter a sua identidade e as suas propriedades. Fazendo uma analogia simplista, os átomos seriam como os tijolos.

Na construção civil, os tijolos são a menor unidade utilizada para dar forma a uma parede, a qual dará origem a uma casa ou um edifício. Os átomos podem ser entendidos como os tijolos das moléculas. A união de diversas moléculas forma a matéria como vemos e vivenciamos.
O conceito de átomo também pode ser entendido como a menor unidade em que a matéria pode ser dividida, sem formar partículas carregadas. O primeiro modelo proposto para explicar os átomos determinava que o átomo é indivisível. Contudo, algum tempo depois, foi entendido que o átomo não é uma unidade, mas sim formado por diversas subpartículas que possuem cargas e massas diferentes, contribuindo para sua estabilidade.
Composição e estrutura do átomo
As teorias propostas para explicar a estrutura do átomo evoluíram ao longo do tempo. A teoria atômica mais moderna considera o átomo formado por duas principais regiões ― núcleo e eletrosfera ― e por três principais partículas subatômicas, que se diferem pela massa e pela carga elétrica, conforme mostrado na tabela:
|
Partícula fundamental |
Símbolo |
Massa aproximada / kg |
Massa relativa |
Carga elétrica |
|
Próton |
p+ |
1,6 x 10-27 |
1 |
+1 |
|
Nêutron |
n0 |
1,6 x 10-27 |
1 |
0 |
|
Elétron |
e- |
9,1 x 10-31 |
1/1836 |
-1 |
O núcleo é a região central do átomo e abriga os prótons e os nêutrons. É pequeno, denso e possui carga elétrica positiva. O núcleo é cercado pela eletrosfera, uma grande região vazia habitada por elétrons, que possuem carga elétrica negativa. No modelo atômico proposto por Schrödinger, a eletrosfera é mais bem definida como uma “nuvem de elétrons”.
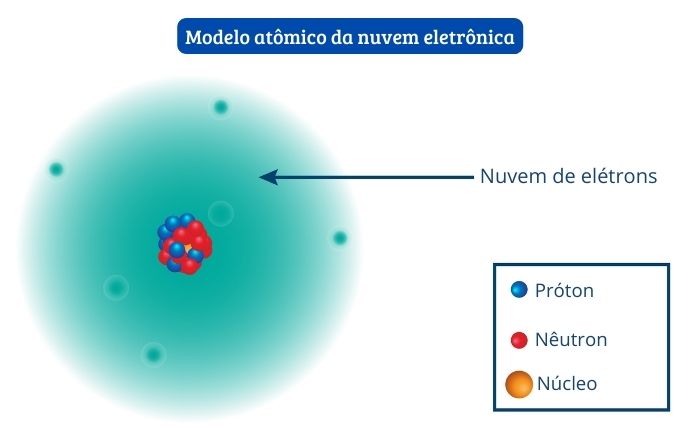
As forças elétricas de atração são responsáveis por manter os elétrons, de carga negativa, em torno do núcleo, de caráter positivo.
Além de prótons, nêutrons e elétrons, existem outras partículas fundamentais que constituem o átomo, como os neutrinos, os quarks, os glúons, entre outras. Essas partículas podem estar associadas à radiação eletromagnética e às forças de atração, por exemplo, e contribuem para a estabilidade energética do átomo.
Os neutrinos possuem carga neutra e massa muito pequena. Os quarks são as unidades de construção dos prótons e dos nêutrons. Os glúons podem ser entendidos como a força que mantém os quarks unidos.
Quais as propriedades do átomo?
As propriedades de um átomo são definidas, basicamente, pela quantidade de prótons no núcleo e pelo arranjo dos elétrons. Veja as propriedades do átomo a seguir.
-
Número atômico
O número atômico (Z) é a identidade de um elemento químico. O valor de Z indica a quantidade de prótons no núcleo e é a propriedade usada para diferenciar os elementos. A sequência dos elementos na Tabela Periódica é dada em função de seu crescente número atômico.
-
Número de massa
O número de massa (A) representa a quantidade de prótons e de nêutrons no núcleo, de modo que indica a massa atômica do elemento. Os elétrons são extremamente leves e praticamente não contribuem para a massa de um átomo. Os isótopos de um mesmo elemento químico se diferenciam pelo número de massa.
-
Tamanho
O tamanho de um átomo pode ser estimado por meio de seu raio atômico. A medida do raio atômico é uma estimativa da distância entre o núcleo e a camada de valência, que é a última camada ocupada por elétrons.
Como a eletrosfera não possui limites bem definidos, o raio atômico pode ser estimado pela distância entre os núcleos de dois átomos ligados, sendo o raio atômico equivalente à metade dessa distância.
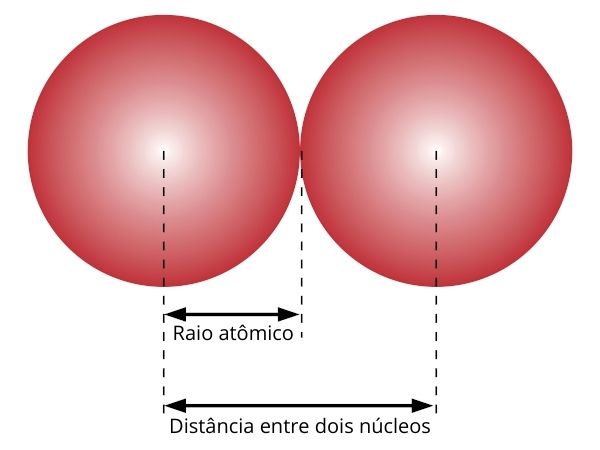
A medida de raio atômico não é fixa. Pode haver expansão ou contração sob incidência de radiação eletromagnética ou pela força de interação entre elétrons e núcleo.
O uso do termo “raio atômico” induz à interpretação de que a eletrosfera é sempre esférica, no entanto, essa ideia não é sempre verdadeira. Por isso, a medida de raio atômico deve ser entendida como uma estimativa para o tamanho do átomo.
-
Estabilidade do núcleo
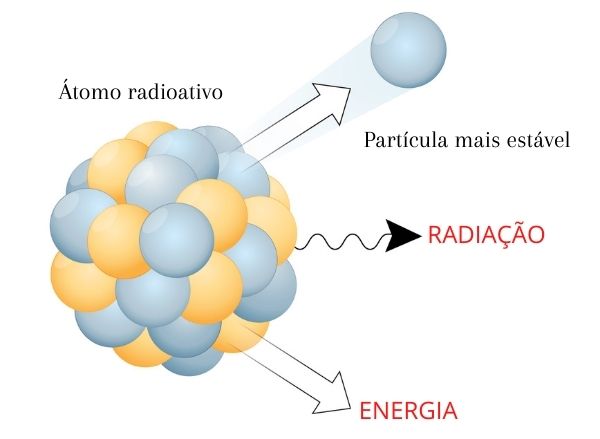
Alguns átomos manifestam o fenômeno de decaimento radioativo, o qual advém da existência de um núcleo instável. O núcleo do átomo pode ser instável quando este possui um raio atômico relativamente grande e a força forte (força de coesão que mantém prótons e nêutrons unidos) não é grande o suficiente para manter as partículas juntas.
O decaimento radioativo é um processo natural de transformação de núcleos instáveis em átomos de maior estabilidade, por meio da emissão de partículas e de radiação eletromagnética.
Semelhança atômica: quais são os tipos de átomos?
Os átomos podem apresentar semelhanças em sua estrutura atômica, tais como a mesma quantidade de prótons ou igual número de massa, podendo se dividir em grupos, de acordo com a similaridade identificada. Nesse sentido, há quatro tipos principais de átomos: isótopos, isóbaros, isótonos e isoeletrônicos. Veja cada um deles a seguir.
-
Isótopos
O conjunto de átomos de um mesmo elemento químico com números de massa diferentes. Ou seja, são átomos que têm a mesma quantidade de prótons (igual número atômico) e se diferem no número de nêutrons. O átomo de carbono possui três isótopos. Veja:
|
Representação |
Número atômico = número de prótons |
Número de massa = prótons + nêutrons |
Número de nêutrons |
|
\({_\mathbf{6}^{\mathbf{12}}}{C}\) |
6 |
12 |
6 |
|
\({_\mathbf{6}^{\mathbf{13}}}{C}\) |
6 |
13 |
7 |
|
\({_\mathbf{6}^{\mathbf{14}}}{C}\) |
6 |
14 |
8 |
Cada isótopo possui uma massa atômica diferente, em razão da quantidade de nêutrons. Assim, a massa relativa de um átomo é dada pela média ponderada, considerando a abundância natural relativa de cada isótopo.
-
Isóbaros
O conjunto de átomos que são elementos químicos diferentes com igual número de massa, isto é, têm diferentes quantidades de prótons. O cálcio, o potássio e o argônio formam um conjunto de isóbaros. Veja:
|
Representação |
Número atômico = número de prótons |
Número de massa = prótons + nêutrons |
Número de nêutrons |
|
\({_\mathbf{20}^{\mathbf{40}}}{Ca}\) |
20 |
40 |
20 |
|
\({_\mathbf{19}^{\mathbf{40}}}{K}\) |
19 |
40 |
21 |
|
\({_\mathbf{18}^{\mathbf{40}}}{Ar}\) |
18 |
40 |
22 |
-
Isótonos
O conjunto de átomos cuja única similaridade é o número de nêutrons e que se diferem pelo número atômico e pelo número de massa. Veja:
|
Representação |
Número atômico = número de prótons |
Número de massa = prótons + nêutrons |
Número de nêutrons |
|
\({_\mathbf{5}^{\mathbf{11}}}{B}\) |
5 |
11 |
6 |
|
\({_\mathbf{6}^{\mathbf{12}}}{C}\) |
6 |
12 |
6 |
-
Isoeletrônicos
O termo isoeletrônico é utilizado quando elementos químicos diferentes estão com a mesma quantidade de elétrons. Porém, para que isso aconteça, os átomos devem ganhar ou perder elétrons, perdendo a sua eletroneutralidade e assumindo um valor de carga elétrica. Nesse caso, eles não são mais átomos e são chamados de íons.
Saiba mais: Alotropia — a possibilidade de diferentes substâncias simples para um mesmo elemento
História do átomo e modelos atômicos
Como átomos são extremamente pequenos, e a sua observação a olho nu é impossível, desde muito tempo cientistas (e até mesmo filósofos) foram responsáveis pela proposição de modelos e comparações que visavam a explicar o comportamento da matéria, com base no conhecimento científico e ferramentas de laboratório disponíveis em cada época.
O mais remoto registro identificado sobre tentativas de explicação acerca do comportamento da matéria remonta ao século V a.C. De forma muito simples, Demócrito e Leucipo propuseram que a matéria seria formada por pequeníssimas partículas, com distintos formatos e tamanhos, que poderiam se combinar.
Por acreditarem que tais partículas seriam indivisíveis, esses pensadores as nomearam “átomos”, que em grego possui sentido de “não divisível”. Nos dias atuais, mesmo sabendo que o átomo é divisível, esse nome ainda é utilizado.
Essa interpretação da estrutura da matéria foi deixada de lado depois de Aristóteles defender que a matéria seria composta pela combinação de quatro elementos: ar, água, terra e fogo.

A interpretação sobre os quatro elementos apenas foi superada em 1803, quando o químico John Dalton propôs um modelo atômico que considerava o átomo uma esfera maciça, eletricamente neutra e indivisível. Em razão dessas características, a proposta de Dalton ficou conhecida como “modelo da bola de bilhar”.
Em 1898, Joseph J. Thomson, realizando experimentos com raios catódicos, notou a ocorrência de desvios de trajetória desses raios ao passarem entre placas metálicas carregadas positiva e negativamente.
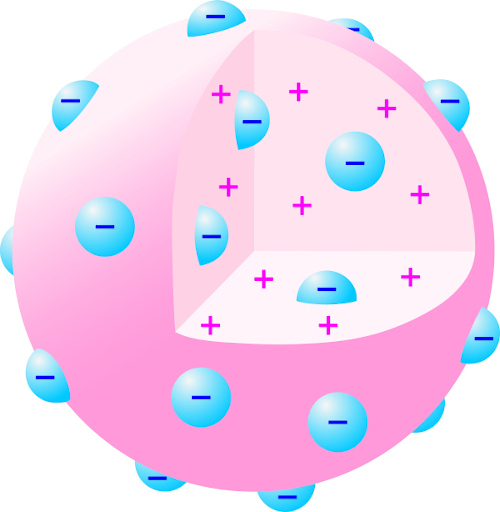
Pela interpretação dessa evidência experimental, Thomson propôs a existência de partículas carregadas no átomo. Em seu modelo, ele defendia que o átomo era uma esfera não maciça de caráter positivo, com pequenos pontos de carga negativa. Esse modelo é conhecido como “modelo pudim de passas”.
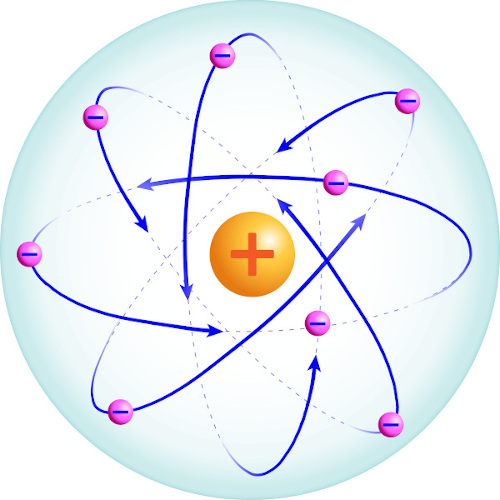
Anos mais tarde, em 1911, o físico Ernest Rutherford, realizando experimentos sobre radioatividade, notou que um feixe de partículas alfa era desviado ao ser incidido sobre uma lâmina de ouro.
Esse resultado ajudou-o a propor um modelo em que o átomo seria formado por uma região pequena, maciça e densa, a qual chamou de núcleo. Além do núcleo, seria formado também por um espaço ao redor do núcleo, com baixa densidade e habitado por elétrons.
Como os elétrons orbitam o núcleo, a proposta de Rutherford ficou conhecida como “modelo do sistema planetário”.
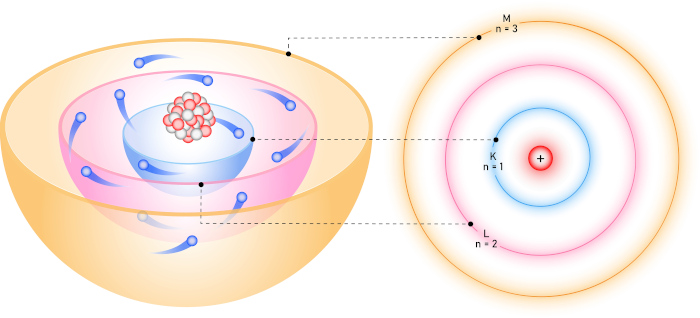
Em seguida, em 1913, Niels Bohr fez uma importante contribuição ao modelo proposto por Rutherford. Segundo os postulados propostos por Bohr, os elétrons se movimentariam ao redor do núcleo, respeitando órbitas circulares com energias definidas. Com essa ideia, Bohr propôs que o átomo é formado por camadas eletrônicas ou níveis de energia e que os elétrons podem transitar entre esses níveis por meio da absorção ou liberação de energia.
Nos anos posteriores, outros cientistas fizeram atualizações importantes no modelo atômico de Rutherford-Bohr. Em 1916, ao se dedicar aos estudos de espectros de emissão dos átomos, Arnold Sommerfeld propôs a ideia que lançou luz aos subníveis energéticos, pois sugeriu que as camadas da eletrosfera seriam formadas por outras subcamadas, as quais teriam novas trajetórias para os elétrons, além da órbita esférica.
Em 1932, James Chadwick foi responsável por comprovar a existência dos nêutrons, os quais já tinham a sua existência investigada como uma possível explicação à aglomeração de partículas positivas no núcleo.
Os avanços na Mecânica Quântica obtidos por Louis de Broglie e Werner Heisenberg atuaram como base para o fato de que Erwin Schrödinger atualizou a ideia de eletrosfera.
Matematicamente, Schrödinger foi capaz de determinar que a eletrosfera consiste, na realidade, em regiões do espaço com diferentes probabilidades de se encontrar o elétron. Ele também definiu que essas regiões podem assumir diferentes geometrias e as denominou orbitais. Esses aspectos levaram ao modelo atômico quântico.
-
Videoaula sobre modelos atômicos
Curiosidades sobre os átomos
-
O diâmetro de um átomo está na ordem de 10-10 m.
-
O diâmetro do núcleo do átomo está na ordem de 10-15 m, quase 100 mil vezes menor do que o próprio átomo.
-
Considerando a perspectiva de que o átomo seja do tamanho do Maracanã, seu núcleo estaria na mesma dimensão de tamanho de uma ervilha.
-
O próton é 1836 vezes mais pesado do que um elétron.
-
Atualmente, são conhecidas cerca de 12 partículas subatômicas diferentes.
-
O grafeno é uma lâmina de carbono com espessura de um único átomo, sendo 100 mil vezes mais fino do que um fio de cabelo.
-
Em 2020, pesquisadores conseguiram observar, pela primeira vez, a posição exata de átomos em uma molécula de proteína por meio da técnica de Criomicroscopia Eletrônica de Transmissão.