Moléculas polares
Moléculas polares são aquelas que apresentam polos (positivo e negativo) e unem-se por meio desses polos, ou seja, polo positivo de uma molécula liga-se ao polo negativo da outra. A identificação de uma determinada molécula como polar ou não é importante no que diz respeito a vários assuntos, a saber:
-
Solubilidade: se uma substância apresenta moléculas polares, a tendência é que ela se dissolva em uma substância polar ou que dissolva uma substância polar;
-
Ponto de fusão e ponto de ebulição: a polaridade de uma molécula pode indicar a temperatura em que ela sofre modificação de estado físico;
-
Forças intermoleculares: a força intermolecular que une moléculas polares é maior do que a que une moléculas apolares, o que influencia, por exemplo, o estado físico da substância no ambiente.
Para determinar se uma molécula é polar, é fundamental avaliar os seguintes aspectos:
-
Geometria da molécula (posicionamento dos átomos no espaço e em torno do átomo central);
Não pare agora... Tem mais depois da publicidade ;) -
Vetor momento dipolar da molécula (indica o átomo mais eletronegativo);
-
A quantidade de ligantes no átomo central da molécula (número de átomos ligados ao átomo central);
-
A quantidade de nuvens eletrônicas no átomo central (quantidade de ligações ou pares de elétrons no átomo central).
Veja a seguir vários exemplos de moléculas polares:
-
Ácido clorídrico (HCl)
Como o ácido clorídrico possui moléculas diatômicas com átomos de elementos diferentes e, consequentemente, com diferentes eletronegatividades, temos uma única nuvem e também um único vetor, logo, esse tipo de molécula é sempre polar.
-
Ácido sulfídrico (H2S)
a) Em relação ao número de nuvens
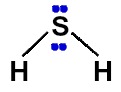
Nuvens eletrônicas na molécula de H2S
Na molécula de ácido sulfídrico, temos as seguintes características:
-
Duas ligações químicas com dois átomos de um mesmo elemento;
-
Cada uma das ligações químicas entre o hidrogênio e o enxofre é do tipo simples;
-
Cada ligação entre o hidrogênio e o enxofre é uma nuvem eletrônica;
-
O enxofre apresenta dois pares de elétrons não ligantes porque possui seis elétrons (por ser da família VIA) na camada de valência e apenas dois deles estão sendo utilizados nas ligações simples.
b) Em relação aos vetores
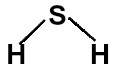
A molécula de ácido sulfídrico apresenta geometria angular (por apresentar dois ligantes e quatro nuvens no átomo central), como representado na estrutura a seguir:
Como o enxofre é mais eletronegativo que os hidrogênios ligados a ele, temos a presença de dois vetores (diagonais) dipolares saindo dos hidrogênios em direção ao enxofre.
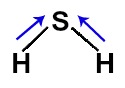
Vetores representados na fórmula estrutural do H2S
Os vetores diagonais devem ser decompostos unindo-se suas partes traseiras por meio da regra do paralelogramo e formando um único vetor resultante em direção ao enxofre:
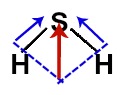
Por fim, temos no H2S apenas um único vetor em direção ao enxofre, por isso, na molécula de H2S, temos um momento dipolar diferente de zero.
-
Amônia (NH3)
a) Em relação ao número de nuvens
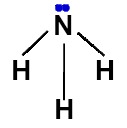
Nuvens eletrônicas na molécula de amônia
Na molécula da amônia, temos as seguintes características:
-
Três ligações químicas com três átomos de um mesmo elemento;
-
Cada uma das ligações químicas entre o hidrogênio e o nitrogênio é do tipo simples;
-
Cada ligação entre o hidrogênio e o nitrogênio é uma nuvem eletrônica;
-
O nitrogênio apresenta um par de elétrons não ligantes porque possui cinco elétrons (por ser da família VA) na camada de valência e três deles estão sendo utilizados nas ligações simples.
b) Em relação aos vetores
A molécula de amônia apresenta geometria piramidal (por apresentar três ligantes e quatro nuvens no átomo central), como representado na estrutura a seguir:
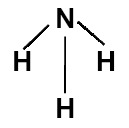
Fórmula estrutural da amônia
Como o nitrogênio é mais eletronegativo que os hidrogênios ligados a ele, temos a presença de três vetores (dois diagonais e um vertical) dipolares saindo dos hidrogênios em direção ao nitrogênio.
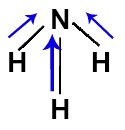
Vetores representados na fórmula estrutural da amônia
Os vetores diagonais devem ser decompostos unindo-se suas partes traseiras por meio da regra do paralelogramo e formando um único vetor resultante em direção ao nitrogênio.
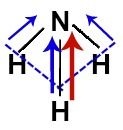
Por fim, temos na amônia apenas dois vetores em direção ao nitrogênio. Por estarem no mesmo sentido, eles devem ser somados. Assim, na molécula de amônia, temos uma somatória de vetores, o que resulta em um momento dipolar diferente de zero.

