Polaridade das moléculas
A polaridade de uma molécula consiste na distribuição heterogênea de sua densidade eletrônica, permitindo o aparecimento de regiões parcialmente positivas e negativas, os chamados dipolos. A polaridade de uma molécula é consequência não só da sua geometria molecular, mas também das diferentes eletronegatividades dos átomos presentes.
A polaridade de uma molécula pode ser indicada pela presença do vetor momento dipolar resultante, obtido com base nos vetores momento dipolar, que consistem em representações vetoriais do deslocamento de cargas em uma ligação covalente. A polaridade de uma molécula também auxilia em uma ideia geral de solubilidade, a chamada “regra do semelhante”.
Leia também: Afinal, o que é uma molécula?
Resumo sobre polaridade das moléculas
- A polaridade das moléculas consiste na distribuição desigual das densidades eletrônicas lá presentes.
- Essa distribuição dá origem a regiões parcialmente positivas e parcialmente negativas na molécula.
- A polaridade das moléculas é consequência da sua geometria molecular e das diferenças de eletronegatividade dos átomos presentes.
- Os deslocamentos de cargas ao longo da ligação covalente podem ser indicados pelo chamado vetor momento dipolar.
- O somatório dos vetores momento dipolar origina um vetor momento dipolar resultante, que determinará a polaridade da molécula.
- A polaridade também auxilia em análises gerais acerca da solubilidade das substâncias por meio da “regra do semelhante”.
Videoaula sobre polaridade das moléculas
O que é polaridade de uma molécula?
![Representação gráfica da fórmula molecular da água em texto sobre polaridade das moléculas. [imagem_principal]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2025/08/polaridade-moleculas.jpg)
A polaridade de uma molécula consiste na distribuição desigual da densidade eletrônica de uma molécula, dando origem a regiões parcialmente positivas e parcialmente negativas nela.
A polaridade é consequência direta das diferenças de eletronegatividades dos átomos envolvidos nas ligações covalentes, bem como da geometria molecular.
Outra forma de se referir à polaridade de uma molécula é dizer que ela tem um vetor momento dipolar permanente, comumente representado pela letra grega µ.
Momento dipolar
A diferença de eletronegatividade entre os átomos de uma ligação covalente faz com que a densidade eletrônica dessa ligação se torne desigual, afinal, a eletronegatividade é a capacidade que um átomo tem de atrair para si a densidade eletrônica de uma ligação covalente.
Em outros termos, quanto mais eletronegativo for o elemento, mais ele puxa os elétrons da ligação covalente em sua direção. Isso acarreta uma distorção da nuvem eletrônica e faz surgir uma região mais negativa e outra menos negativa ao longo da ligação covalente, em um efeito conhecido como polarização da ligação.
Obviamente, caso a ligação química seja feita pelos mesmos elementos químicos, não haverá diferença de eletronegatividade e, dessa forma, a distribuição eletrônica da ligação covalente será homogênea.
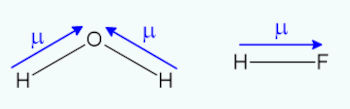
Observe a imagem abaixo:

A polaridade da ligação é consequência direta da diferença de eletronegatividade. No exemplo da imagem, o flúor (F) apresenta maior eletronegatividade que o hidrogênio (H). Como essa movimentação de cargas não acarreta uma ionização de fato, é comum se referir às regiões formadas como cargas parciais.
As cargas parciais são representadas pela letra grega delta (δ) sucedida pela carga. Quanto maior a diferença de eletronegatividade entre os átomos envolvidos na ligação covalente, maior a distorção da nuvem e, consequentemente, mais intensa é essa polarização.
Para determinar a direção, o sentido e a intensidade dessa polarização, utiliza-se o vetor momento dipolar (ou vetor momento dipolar elétrico), em geral representado pela letra grega µ. Tal vetor pode ser representado na estrutura de Lewis de cada molécula, apontando sempre para o elemento mais eletronegativo da ligação.
Como identificar a polaridade das moléculas?
As moléculas polares serão aquelas que têm um vetor momento dipolar permanente. Para moléculas diatômicas, essa avaliação é muito fácil: caso os átomos sejam diferentes (heteronucleares), então a molécula será polar, como no caso de HF, HCl, CO, NO, entre outras.
Isso porque só há uma ligação covalente na molécula e, sendo a ligação polar, a molécula, por consequência, também será polar. Do contrário, moléculas diatômicas formadas pelo mesmo átomo (homonucleares) serão apolares, já que a única ligação covalente existente é apolar, como no caso de H2, O2, F2, Br2, entre outras.
Para moléculas com três ou mais átomos, a avaliação é um pouco mais complexa, pois os diversos vetores momento dipolar devem ser somados de modo que exista um único vetor resultante:
- Caso a resultante da soma dos vetores seja igual a zero, então a molécula é apolar.
- Se a resultante da soma dos vetores for diferente de zero, então um vetor momento dipolar existe e a molécula é considerada polar.
Veja no caso das moléculas CO2 e H2O, representadas nas imagens abaixo.

O CO2 é uma molécula de geometria linear, com ligações C=O em direções opostas. Nesse caso, os vetores momento dipolar são diametralmente opostos e, ao se somarem, anulam-se. Portanto, a combinação dos vetores momento dipolar gera um vetor momento dipolar resultante que é igual a zero (µr = 0). Portanto, o CO2 é uma molécula apolar.
Para H2O, por conta da geometria angular, o somatório dos vetores momento dipolar faz aparecer um vetor momento dipolar resultante diferente de zero (µr ≠ 0). Esse vetor não pode mais ser anulado, tornando-se permanente. Assim sendo, H2O é uma molécula polar.
Veja também: O que é eletropositividade?
Geometria molecular e polaridade das moléculas
A geometria da molécula tem grande influência na polaridade. H2O, fosse uma molécula linear, seria apolar, porém sua a geometria angular torna-a polar. Todavia, nem toda molécula linear é, necessariamente, apolar. HCN, por exemplo, é uma molécula de geometria linear, porém é polar.
Portanto, a relação entre geometria e polaridade vai depender também da natureza das ligações covalentes presentes na molécula. A tabela a seguir traz a relação entre polaridade e as principais geometrias.
|
Geometria |
Polaridade |
Condição |
|
Linear; trigonal plana; tetraédrica; bipirâmide trigonal; octaédrica; quadro planar. |
Ligações covalentes entre os mesmos elementos |
|
|
Polar |
Ligações covalentes entre elementos distintos |
|
|
Angular; piramidal; gangorra; forma de t; pirâmide de base quadrada. |
Polar |
- |
Assim sendo, algumas geometrias vão depender da análise das ligações covalentes para determinação da polaridade. Vejamos alguns exemplos.
|
Molécula |
Polaridade |
Justificativa |
|
Alt: Fórmula estrutural com ligações covalentes entre elementos diferentes. Título: polaridade-moleculas-geometria-1 |
Polar |
Ligações covalentes entre elementos diferentes |
|
Alt: Fórmula estrutural com ligações covalentes entre elementos iguais. Título: polaridade-moleculas-geometria-2 |
Apolar |
Ligações covalentes entre elementos iguais |
|
Alt: Fórmula estrutural de uma substância com molécula polar. Título: polaridade-moleculas-geometria-3 |
Polar |
Ligações covalentes entre elementos diferentes |
|
Alt: Fórmula estrutural de uma substância com molécula apolar. Título: polaridade-moleculas-geometria-4 |
Apolar |
Ligações covalentes entre elementos iguais |
Polaridade e solubilidade
A polaridade auxilia na compreensão de uma regra de solubilidade chamada de “regra do semelhante”. Segundo essa regra, “semelhante dissolve semelhante”, ou seja, compostos polares são mais facilmente dissolvidos em solventes polares, enquanto compostos apolares são mais facilmente dissolvidos em solventes apolares.
Os óleos, por exemplo, são feitos de moléculas apolares. Por conta disso, nós percebemos que o óleo não é capaz de ser dissolvido em água, uma vez que a água é um solvente polar. Já a propanona e o etanol, moléculas de alto caráter polar, têm uma solubilidade extensa em água.
Isso também é aplicado em nosso cotidiano. Por exemplo, uma tinta à base d’água deve usar água como diluente para aplicação. Já as tintas à base de óleo devem usar solventes apolares como diluente para aplicação, sendo a aguarrás o mais conhecido. Da mesma forma, cosméticos utilizados para maquiagem devem ter um grande número de moléculas apolares na composição, de modo que não sofram interferência do suor, chuva ou lágrimas.
Saiba mais: Como funciona a regra do octeto?
Exercícios resolvidos obre polaridade das moléculas
Questão 1. (Unimontes – Tarde – Biológicas/2024) A eletronegatividade é a capacidade que um átomo tem de atrair para si o par eletrônico que ele compartilha com outro átomo, em uma ligação covalente. Assim, afirma-se que a medida da polaridade das ligações (e das moléculas) é feita pelo chamado momento dipolar, que é o produto do módulo da carga parcial (δ) pela distância entre os dois extremos de um dipolo.
Dessa forma, é CORRETO afirmar que a molécula que representa um dipolo é o
- tetraclorometano.
- triclorometano.
- diclorometano.
- metano.
Resposta: Letra B.
O triclorometano CHCl3 apresenta a seguinte estrutura:
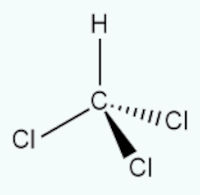
Percebe-se, pelo arranjo tetraédrico, que o hidrogênio, sozinho, cria um momento dipolar com os átomos de cloro, muito por conta da diferença de eletronegatividade. Assim sendo, a molécula não terá um dipolo resultante igual a zero, sendo considerada polar.
Questão 2. (Campo Real – Medicina/2023.1) A eletronegatividade, segundo Pauling (1931) baseado na definição de Berzelius (1811), é a medida da capacidade de um átomo, em uma molécula, de atrair elétrons. Pauling determinou a eletronegatividade a partir da energia de dissociação de moléculas diatômicas, sendo que se pode utilizar a diferença de eletronegatividade entre dois átomos participantes de uma ligação como medida da polaridade de uma molécula.
Como exemplo, a tabela a seguir indica a eletronegatividade dos halogênios.
|
Elemento |
Eletronegatividade |
|
F |
4,0 |
|
Cl |
3,0 |
|
Br |
2,8 |
|
I |
2,5 |
|
At |
2,2 |
Com relação às informações apresentadas, considerando apenas a polaridade das moléculas e a eletronegatividade do hidrogênio como 2,1, assinale a alternativa que apresenta o ácido halogenídrico (HX) mais solúvel em hidrocarbonetos.
- HF.
- HAt.
- HCl.
- HBr.
- HI.
Resposta: Letra B.
Segundo a regra do semelhante (semelhante dissolve semelhante), o ácido halogenídrico mais solúvel em hidrocarbonetos será aquele de menor caráter polar, pois os hidrocarbonetos são apolares ou muito pouco polares. Sendo moléculas diatômicas, a polaridade é determinada por uma simples diferença dos valores da eletronegatividade. A menor diferença de eletronegatividade será a do HAt, já que a eletronegatividade do astato é 2,2 e a do hidrogênio é 2,1.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
FRANCISCO, F. M.; DO CANTO, E. L. Química na abordagem do cotidiano. 5ª ed. vol. 1. São Paulo: Moderna, 2009.
REIS, M. Química: ensino médio. 2ª ed. vol. 1. São Paulo: Ática, 2016.
USBERCO, J.; SPITALERI, P.; SALVADOR, E. Química 1: conecte live. 3ª ed. vol. 1. São Paulo: Saraiva, 2018.

