Camada de valência
A camada de valência é a camada mais externa do átomo e é o último nível preenchido por elétrons. De acordo com a teoria atômica de Rutherford-Bohr, a eletrosfera é formada por níveis ou camadas, as quais aumentam em energia conforme se afastam do núcleo do átomo. Assim, a camada de valência é o nível eletrônico de maior energia.
Leia também: Qual é a estrutura do átomo?
Resumo sobre camada de valência
- A camada de valência é a camada mais externa do átomo e é o nível de maior energia.
- É o último nível eletrônico preenchido por elétrons.
- Os elétrons que a preenchem são chamados elétrons de valência.
- São os elétrons de valência que estabelecem as ligações químicas e participam da formação de íons.
- O número de elétrons de valência determina algumas propriedades dos elementos, como a reatividade.
- a camada de valência pode ser determinada pela distribuição eletrônica, utilizando o diagrama de Linus Pauling.
- A Tabela Periódica também pode ser empregada para descobrir a camada de valência.
- Na Tabela Periódica, os períodos se referem ao nível eletrônico ocupado e os grupos se associam ao número de elétrons de valência.
O que é camada de valência?
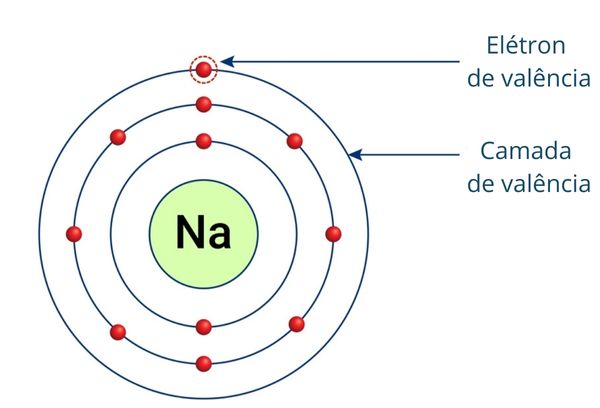
A camada de valência é a última camada da eletrosfera ocupada por elétrons de um átomo, sendo a mais externa e distante do núcleo do átomo.
Segundo o modelo atômico de Rutherford-Bohr, a eletrosfera dos átomos é formada por até sete camadas eletrônicas, porém nem todas as camadas estarão preenchidas, sendo a de valência a última ocupada por elétrons.
As camadas da eletrosfera possuem energia crescente conforme estão mais distantes do núcleo. Como a camada de valência é a mais externa do átomo, ela é a camada de maior energia. Os elétrons que a ocupam também apresentam maior energia e são os responsáveis pelo estabelecimento das ligações químicas e pela formação de íons, sendo denominados elétrons de valência.
Camadas da eletrosfera
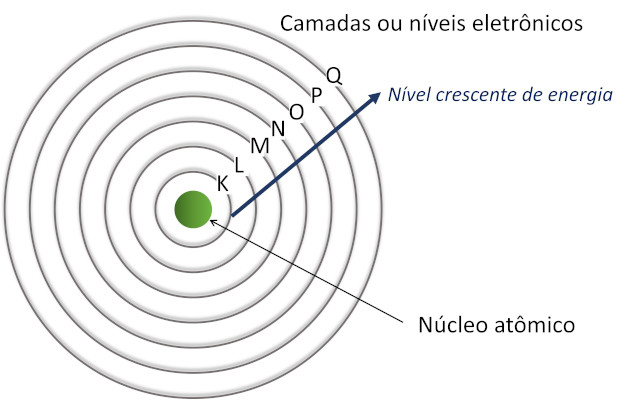
As camadas da eletrosfera são órbitas circulares ao redor do núcleo do átomo que possuem energias específicas e bem definidas, de acordo com o modelo atômico de Rutherford-Bohr. Também são conhecidas como níveis de energia.
Os elétrons que habitam a eletrosfera apenas podem estar localizados dentro dessas camadas ou níveis, possuindo a energia da própria camada.
Os átomos têm de uma a sete camadas eletrônicas, representadas por letras do alfabeto:
- K
- L
- M
- N
- O
- P
- Q
A camada K é a mais próxima do núcleo atômico e tem a menor energia possível. Quanto mais distante do núcleo, maior será a energia associada à camada ou ao nível.
Cada uma dessas camadas eletrônicas é ainda formada por subníveis, os quais comportam um número máximo de elétrons.
- Subnível s: comporta dois elétrons.
- Subnível p: comporta seis elétrons.
- Subnível d: comporta 10 elétrons.
- Subnível f: comporta 14 elétrons.
Por questões energéticas, nem todas as camadas possuem todos os subníveis. Por exemplo, a camada K possui apenas o subnível s, enquanto a camada N comporta os quatro subníveis.
Como as camadas eletrônicas têm diferentes subníveis, elas conseguem comportar diferentes quantidades de elétrons. Veja:
- Camada K: subnível s — dois elétrons
- Camada L: subníveis s e p — oito elétrons
- Camada M: subníveis s, p e d — 18 elétrons
- Camada N: subníveis s, p, d e f — 32 elétrons
- Camada O: subníveis s, p, d e f — 32 elétrons
- Camada P: subníveis s, p e d — 18 elétrons
- Camada Q: subníveis s e p — dois elétrons
Assim, considerando um átomo que tenha a camada M como camada de valência, ela comportará até 18 elétrons.
Elétrons na camada de valência
Os elétrons que preenchem a camada de valência são chamados de elétrons de valência e são os mais externos do átomo.
Como esses elétrons estão localizados na camada mais externa do átomo, são eles que participam da formação de ligações químicas, dos processos de formação de cátions e ânions, e determinam as propriedades químicas dos elementos.
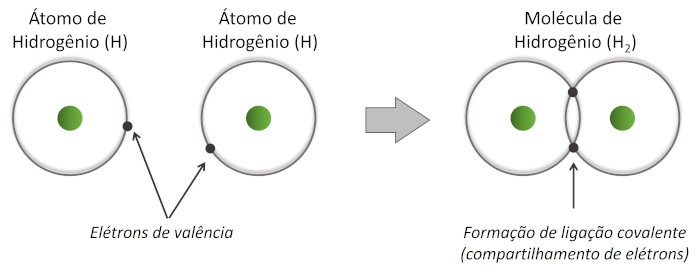
A ilustração abaixo representa a formação de uma ligação covalente entre dois átomos de hidrogênio por meio do compartilhamento dos elétrons de valência de cada átomo.
Uma grande parte dos elementos químicos se enquadra na teoria do octeto, que defende que o átomo atinge a sua estabilidade ao completar a camada de valência com oito elétrons.
Assim, a reatividade, ou a tendência de os elementos formarem ligações químicas, se deve à quantidade de elétrons na camada de valência:
- Átomos que possuem a camada de valência completa, isto é, com oito elétrons, tendem a ser quimicamente inertes, não formando ligações químicas com outros elementos.
- Átomos com um ou dois elétrons na camada de valência são bastante reativos, com alta tendência em doar esses elétrons, formando íons positivos (cátions).
- Átomos que possuem seis ou sete elétrons de valência também são reativos, com forte tendência em receber elétrons para completar a valência, formando íons negativos (ânions).
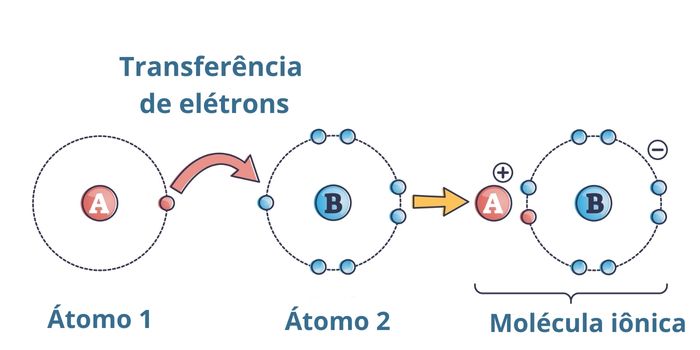
Quando um par de elementos químicos doa seus elétrons entre si e permanece unido por meio da interação eletrostática gerada, forma-se a ligação iônica. A ilustração abaixo representa isso mostrando o átomo 1 doando seu único elétron de valência para o átomo 2, que, então, passa a ter a sua camada de valência completa.
Leia também: Quais são as exceções à regra do octeto?
Como encontrar a camada de valência?
A camada de valência para um átomo pode ser encontrada por meio de sua distribuição eletrônica ou pela posição que ocupa na Tabela Periódica.
→ Distribuição eletrônica
A distribuição eletrônica é a sequência com que os elétrons ocupam os níveis de energia dos átomos, respeitando o sentido crescente de energia. A distribuição eletrônica é facilmente obtida pela aplicação do diagrama de Linus Pauling, que organiza os níveis e subníveis em ordem de energia, respeitando a quantidade de elétrons que pode ser alocada em cada subnível.

Para descobrir o número de elétrons de um elemento a serem distribuídos, basta conhecer seu número atômico (Z), que equivale à quantidade de prótons. É bom lembrar que, em um átomo neutro, o número de prótons e o de elétrons são o mesmo. Veja alguns exemplos de como encontrar a camada de valência:
- Oxigênio (Z = 8): há oito elétrons a serem distribuídos e a configuração eletrônica é 1s2 2s2 2p4.

De acordo com a configuração eletrônica, a última camada ocupada (camada de valência) do oxigênio é o nível 2, preenchido com seis elétrons, os elétrons de valência.
- Cálcio (Z = 20): há 20 elétrons a serem distribuídos e a configuração eletrônica é 1s2 2s2 2p6 3s2 3p6 4s2.

Para o cálcio, a última camada ocupada é o nível 4, preenchido com apenas dois elétrons, os elétrons de valência.
→ Tabela Periódica
A Tabela Periódica dos elementos químicos é organizada em colunas verticais, chamadas de grupos, e linhas horizontais, os períodos.
- Períodos (linhas horizontais): variam de um a sete e indicam diretamente quais camadas da eletrosfera de um elemento estão ocupadas por elétrons. A camada de valência será o último nível energético ocupado. Por exemplo, o elemento oxigênio ocupa o segundo período na Tabela Periódica, logo, sua camada de valência está no segundo nível (camada L). O elemento cálcio pertence ao quarto período, indicando que sua última camada ocupada por elétrons é a quarta (camada N).
- Grupos (linhas verticais): agrupam elementos químicos que possuem propriedades físico-químicas semelhantes. Os elementos químicos de um mesmo grupo possuem a mesma quantidade de elétrons de valência. Os elementos pertencentes ao grupo 1 da tabela possuem apenas um elétron de valência. Os elementos do grupo 2 têm em sua camada de valência dois elétrons. Os representantes do grupo 13 mantêm três elétrons de valência. Os elementos do último grupo (grupo 18) possuem oito elétrons em sua camada de valência. Por exemplo, o elemento oxigênio pertence ao grupo 16, logo, sua camada de valência possui seis elétrons. Da mesma forma, o elemento cálcio se encontra no grupo 2 e mantém apenas dois elétrons de valência.
Perceba que a análise dos elementos oxigênio e cálcio resultou na mesma conclusão, considerando tanto a distribuição eletrônica como a localização deles na Tabela Periódica.
Saiba mais: Distribuição eletrônica e Tabela Periódica — como se relacionam?
Exercícios resolvidos sobre camada de valência
Questão 1
Os elementos I, II e III possuem as seguintes configurações eletrônicas:
I. 1s2 2s2 2p5
II. 1s2 2s2 2p6 3s2 3p6 4s2
III. 1s2 2s2 2p6 3s2 3p6
Baseado(a) nisso, indique a afirmativa correta:
A) O elemento I é um gás nobre.
B) O elemento II pertence ao grupo dos metais alcalinos.
C) Os elétrons de valência do elemento II são mais energéticos do que os elétrons de valência do elemento III.
D) Os elementos I e III pertencem ao mesmo período da Tabela Periódica.
Resolução:
Alternativa C
Item A incorreto. O elemento I é um halogênio. Esse elemento possui camada de valência 2s2 2p5, portanto, possui sete elétrons de valência, pertencendo ao grupo 17 da Tabela Periódica.
Item B incorreto. O elemento II pertence ao grupo dos metais alcalinos-terrosos. Como a camada de valência é 4s2, conclui-se que esse elemento químico pertence ao segundo grupo da Tabela Periódica, o grupo dos metais alcalino-terrosos.
Item C correto. O elemento II possui camada de valência 4s2, indicando que a quarta camada está preenchida por elétrons. O elemento III possui camada de valência 3s2 3p6, indicando que possui elétrons até a terceira camada. As energias das camadas aumentam conforme se distanciam do núcleo. Sabendo que a energia dos elétrons é igual à energia das camadas, os elétrons do elemento II são mais energéticos que os elétrons do elemento III.
Item D incorreto. O elemento I pertence ao segundo período enquanto o elemento III pertence ao terceiro período.
Questão 2
(Enem) Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5s2 5p6) e o hexafluoreto de platina, e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s2 2p5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
Ao se escrever a fórmula de Lewis do composto de xenônio citado, quantos elétrons na camada de valência haverá no átomo do gás nobre?
A) 6
B) 8
C) 10
D) 12
E) 14
Resolução:
Alternativa C
A questão aborda conceitos de camada de valência e estrutura de Lewis. No entanto, é possível respondê-la considerando apenas os conhecimentos de camada e elétrons de valência.
A questão informa que o composto difluoreto de xenônio é formado pelo estabelecimento de ligação covalente entre dois átomos de flúor e um de xenônio:
- A camada de valência do flúor é 2s2 2p5, indicando sete elétrons de valência.
- A camada de valência do xenônio é 5s2 5p6, indicando oito elétrons de valência.
Na formação do composto difluoreto de xenônio, além dos oito elétrons de valência do xenônio, esse elemento receberá mais dois elétrons (um de cada átomo de flúor), adquirindo então 10 elétrons em sua camada de valência. Perceba que o texto informa que o xenônio não obedece à regra do octeto.

