Polaridade das Ligações
Em nosso cotidiano podemos perceber diferenças entre substâncias iônicas, metálicas e moleculares. Por exemplo, em geral, as iônicas e metálicas são sólidas a temperatura ambiente; enquanto que as moleculares podem ser encontradas nos três estados físicos.
Essas e outras diferenças entre as substâncias estão relacionadas com as polaridades das ligações que os átomos estabelecem entre si. Vejamos as possibilidades:
- Ligação iônica: É a força que mantém os íons unidos, depois que um átomo cede definitivamente um, dois ou mais elétrons para outro átomo.
Portanto, visto que há a transferência de elétrons com a formação de íons positivos (cátions) e íons negativos (ânions), acarretando a formação de compostos que sempre terão polos.
Assim, chegamos a seguinte conclusão:

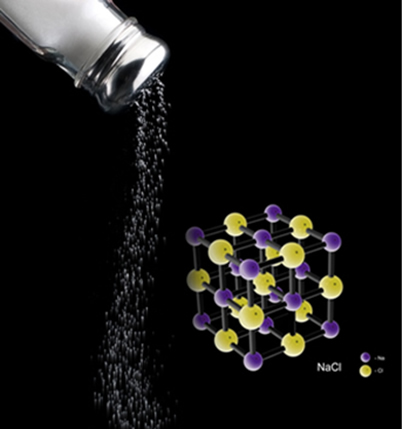
Por exemplo, o sal (cloreto de sódio) é formado quando o sódio cede definitivamente um elétron para o cloro. Assim, temos o cátion sódio e ânion cloreto, que são respectivamente o polo positivo e o polo negativo da ligação. Portanto, essa diferença de eletronegatividade faz com que o sal seja polar.

- Ligação covalente: É a união entre átomos estabelecida por pares de elétrons, ou seja, por compartilhamento desses elétrons.
Nesse caso, nós podemos ter as duas possibilidades: ligação covalente polar e ligação covalente apolar. Para determinar a polaridade desse tipo de ligação temos que analisar a eletronegatividade dos átomos dos elementos ligantes.
- Ligação covalente apolar: Se o compartilhamento de elétrons for realizado por átomos de mesma eletronegatividade, a distribuição da carga vai ser simétrica, sem formação de polos na molécula e, consequentemente, essa ligação será classificada como ligação covalente apolar.
Um exemplo é o gás oxigênio (O2), formado pela ligação entre dois átomos do mesmo elemento:

Outros gases que são substâncias simples, também possuem ligação covalente apolar, tais como: gás nitrogênio (N2), gás hidrogênio (H2) e gás cloro (Cl2).
- Ligação covalente polar: Se o compartilhamento de elétrons for feito entre átomos de diferentes eletronegatividades, a distribuição da nuvem eletrônica na molécula será assimétrica, acarretando uma maior densidade de elétrons ao redor do átomo mais eletronegativo e tornando a ligação e a molécula polar.
Por exemplo, na molécula de gás clorídrico há um acúmulo de carga negativa, em razão do deslocamento dos elétrons pelo cloro, que é mais eletronegativo que o hidrogênio. Essa região é representada por δ-, e a região e menor densidade eletrônica (ao redor do hidrogênio) é representada por δ+. Esses polos constituem um dipolo elétrico.
.jpg)
Quanto maior for a diferença de eletronegatividade entre os átomos dos elementos, maior será a polarização da ligação.
Linus Pauling criou uma escala de eletronegatividade que pode ser de ajuda para determinar a intensidade da polarização de diferentes ligações: