Os Quatro Números Quânticos
No texto “Números Quânticos” você viu que os elétrons são identificados pelos cientistas por seus conteúdos de energia, que podem ser expressos por códigos matemáticos denominados números quânticos.
Cada elétron de um átomo é caracterizado por quatro números quânticos, que são: principal (n), secundário ou azimutal (l), magnético (m ou ml) e spin (s ou mS).
Num mesmo átomo não existem dois elétrons com os mesmos números quânticos.
No texto citado, explicou-se de forma bem detalhada o que é o número quântico principal e o secundário. O principal (n) indica o nível de energia ou camada do elétron:
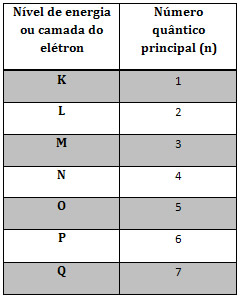
Já o número quântico secundário indica o subnível em que o elétron está:
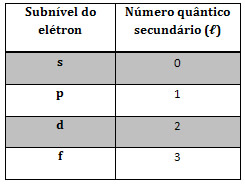
Agora, o número quântico magnético indica a orientação dos orbitais (região de máxima probabilidade de se encontrar o elétron no átomo) no espaço. Os seus valores podem variar de -? a + ?.
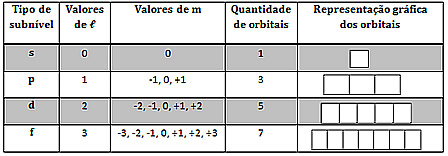
Para entender como determinar esse número quântico, temos de realizar uma representação gráfica dos elétrons em orbitais. Isso é feito geralmente indicando um orbital por um quadrado. Por exemplo, o subnível s só possui um orbital, pois ele tem só uma forma em relação a qualquer orientação espacial, que é esférica.
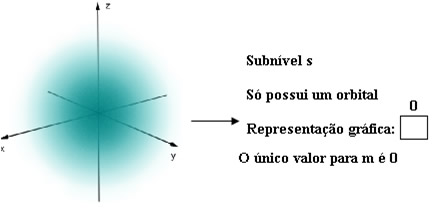
Lembre-se de que cada orbital comporta no máximo dois elétrons e que cada elétron é indicado por uma seta:

Ao preencher esses orbitais, deve-se seguir a Regra de Hund, que diz que isso deve ser feito de modo que tenhamos o maior número possível de elétrons desemparelhados, isto é, isolados. Isso significa que preenchemos todas as setas para cima e só depois voltamos preenchendo com as setas para baixo (ou o contrário, dependendo da forma adotada).
O subnível p possui três orientações espaciais, pois, conforme mostrado abaixo, ele é um duplo ovoide:
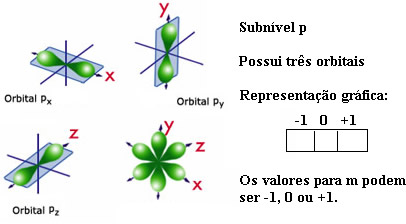
O subnível d possui cinco orientações espaciais e o f possui sete:
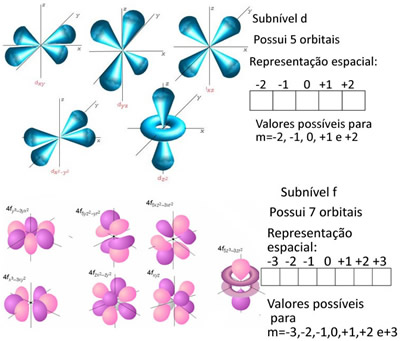
Até o momento, temos:
Enfim, o número quântico do spin mostra o sentido da rotação do elétron.
Dois elétrons num mesmo orbital não se repelem porque cada elétron gira ao redor de seu próprio eixo no sentido horário ou anti-horário. Dois elétrons no orbital giram em sentidos opostos, anulando o magnetismo um do outro e proporcionando um sistema mais estável. Assim, em função dos sentidos de rotação para os elétrons, são conhecidos dois valores para o spin:
s= +1/2 e -1/2
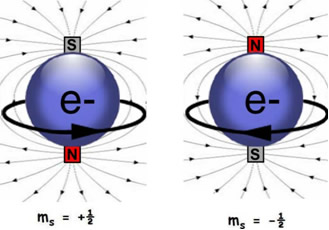
O sentido da seta indicará o spin, que é adotado por convenção. Por exemplo, para o primeiro elétron de um orbital pode-se convencionar que sua identificação começará com todas as setas para cima e que as setas para cima irão indicar o spin -1/2. Assim, as setas para baixo irão indicar o spin igual a +1/2. Mas o contrário também pode ser adotado.
Vejamos um exemplo para ver se você conseguiu entender como se determinam os quatro números quânticos:
Exemplo: Qual é o conjunto dos quatro números quânticos que caracteriza o elétron mais energético do 9F?
Resolução:
Primeiro, encontramos a distribuição eletrônica desse átomo, que é: 1s2 2s2 2p5.
Veja que o elétron mais energético se encontra na camada 2, por isso seu número quântico principal é: n = 2. Seu subnível é p, sendo, portanto, o número quântico secundário igual a l =1.
Agora, para descobrir os outros números quânticos, façamos o preenchimento do orbital desse último subnível. Vamos adotar nesse caso que o primeiro elétron de cada orbital será representado por uma seta para cima (↑) e o valor do spin será igual a -1/2:
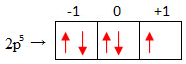
A última seta está no 0. Em razão disso, o valor do número quântico magnético é m = 0. Veja que essa seta está para baixo, então o spin é s = +1/2.
Concluímos, assim, que o conjunto dos quatro números quânticos que caracteriza o elétron mais energético do 9F é n = 2; l =1, m = 0 e s = +1/2.

