Óxido nitroso
O óxido nitroso é um gás de efeito estufa extremamente potente que contribui significativamente para o aquecimento global e para a destruição da camada de ozônio. Nesse contexto, suas emissões são principalmente decorrentes de atividades humanas, particularmente na agricultura e na indústria.
Nesse sentido, ele foi isolado, pela primeira vez, em 1772, por Joseph Priestley, em forma gasosa, a qual foi chamada de “ar nitroso”. Priestley observou seu efeito em apagar chamas e em manter animais vivos em um ambiente sem oxigênio.
Essas observações iniciais foram fundamentais para a posterior compreensão dessa substância, uma vez que, em 1799, Humphry Davy começou a investigar os efeitos do óxido nitroso em si mesmo, inalando o gás em experimentos autorrealizados. Diante disso, ele notou seus efeitos euforizantes e analgésicos, descrevendo a sensação como uma “embriaguez agradável”. Além disso, Davy também sugeriu o uso do óxido nitroso, em procedimentos cirúrgicos, como anestésico.
Leia também: Qual a relação entre chuva ácida e a poluição atmosférica?
Resumo sobre óxido nitroso
-
Óxido nitroso é um composto químico formado por dois átomos de nitrogênio e um átomo de oxigênio (N2O).
-
É um gás incolor, não inflamável e com leve odor adocicado.
-
É conhecido como “gás do riso” devido aos seus efeitos euforizantes quando inalado.
-
É utilizado como anestésico e analgésico em procedimentos médicos e odontológicos.
-
Também é utilizado na indústria alimentícia como propelente em aerossóis.
-
Aumenta a potência dos motores de combustão interna no automobilismo.
-
Contribui para o aquecimento global e a destruição da camada de ozônio quando liberado na atmosfera em grandes quantidades.
-
Contribui para o efeito estufa, com potencial de aquecimento global 298 vezes maior que o CO2 em 100 anos.
-
A exposição aguda a ele pode causar euforia, sedação e analgesia, podendo levar à asfixia em concentrações elevadas.
-
Seu uso recreativo pode causar deficiência severa de vitamina B12 e danos neurológicos.
O que é o óxido nitroso?
O óxido nitroso é um composto químico tipicamente orgânico, ou seja, tem caráter molecular, formado por dois átomos de nitrogênio (N) e um átomo de oxigênio (O) por meio de ligações covalentes. Além disso, sua fórmula química é N2O e pode ser representada estruturalmente da seguinte forma:
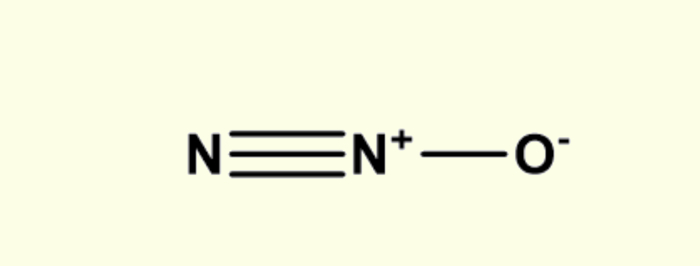
Quais são as propriedades do óxido nitroso?
No que tange às propriedades do óxido nitroso, tanto físicas quanto químicas, podemos listá-las da seguinte forma:
-
Ponto de ebulição: -88,5 °C.
-
Ponto de fusão: -90,8 °C.
-
Densidade: 1,977 g/L (mais denso que o ar).
-
Peso molecular: 44,013 g/mol.
-
Solubilidade em água: moderada (mais solúvel em solventes orgânicos).
-
Decomposição: em temperaturas elevadas, decompõe-se em nitrogênio (N₂) e oxigênio (O₂).
-
Estável sob condições normais de temperatura e pressão.
-
Pressão de vapor: alta, permitindo que seja facilmente liquefeito.
-
Pode atuar como oxidante em reações de combustão.
-
Reatividade: não é inflamável, mas pode suportar a combustão de substâncias que são normalmente difíceis de queimar.
Veja também: Quais são os tipos de óxidos existentes?
Principais características do óxido nitroso
O óxido nitroso tem como uma de suas principais características a capacidade de causar euforia e risos, motivo pelo qual é chamado de gás hilariante. Além disso, é naturalmente gasoso, incolor e incorpora um odor levemente adocicado.
Quais são as aplicações do óxido nitroso?
Quanto às aplicações, o óxido nitroso apresenta diversas utilidades importantes para indústria, medicina e até mesmo em pesquisas científicas, conforme pontuamos a seguir:
-
Óxido nitroso na medicina: usado como anestésico e analgésico em cirurgias e procedimentos odontológicos. Ele ajuda a aliviar a dor e a relaxar os pacientes.
- Óxido nitroso no automobilismo: empregado para aumentar a potência dos motores em carros de corrida, o óxido nitroso melhora a combustão do combustível, proporcionando mais energia e velocidade.

- Óxido nitroso em recreação: conhecido como “gás do riso”, é usado em festas e eventos para causar euforia e risos, embora seu uso recreativo deva ser feito com cautela devido aos riscos à saúde.

-
Óxido nitroso em pesquisa científica: é utilizado em experimentos químicos e estudos atmosféricos, especialmente relacionados ao impacto ambiental dos gases de efeito estufa.
-
Óxido nitroso na indústria alimentícia: é aplicado como propelente em latas de chantilly em spray, ajudando a criar a textura leve e aerada do chantilly.
A obtenção e ocorrência do óxido nitroso
O óxido nitroso pode ser obtido tanto de forma sintética — por meio da decomposição térmica do nitrato de amônio ou por meio da reação de hidróxido de amônio e nitrato de sódio —; bem como pode ocorrer naturalmente em sistemas biológicos. Para uma melhor compreensão, falaremos um pouco sobre cada caso a seguir.
→ Obtenção sintética de óxido nitroso
-
Decomposição térmica do nitrato de amônio (NH4NO3): é principal via industrial para a produção de óxido nitroso. Dessa forma, quando o (NH4NO3) é aquecido em cerca de 250 °C, decompõe-se para formar óxido nitroso e água, conforme a equação química abaixo:
NH4NO3 → N2O + 2H2O
-
Reação de hidróxido de amônio (NH4OH) e nitrito de sódio (NaNO2):
NH4OH + NaNO2 → N2O + NaOH + H2O
→ Ocorrência natural de óxido nitroso
Uma fonte significativa de N2O é o oceano devido à atividade microbiana nas zonas oxigenadas e subóxicas. Ademais, o óxido nitroso é naturalmente produzido por microrganismos no solo e na água por meio dos processos de:
-
Nitrificação: bactérias no solo oxidam o amônio (NH4⁺) a nitrito (NO2⁻) e depois a nitrato (NO3⁻), liberando N2O como subproduto.
-
Desnitrificação: em condições anaeróbicas, bactérias utilizam nitrato (NO3⁻) como aceitador de elétrons, convertendo-o em gás nitrogênio (N2) e liberando N2O intermediariamente.
Os gases do efeito estufa
Em relação aos gases do efeito estufa, o óxido nitroso é um dos mais potentes e está associado ao aquecimento global, assim, contribui para a destruição da camada de ozônio, tornando sua emissão e controle uma preocupação ambiental significativa. Para se ter uma ideia, ele é aproximadamente 298 vezes mais eficaz em aprisionar calor na atmosfera do que o dióxido de carbono (CO2) ao longo de 100 anos. Isso significa que, mesmo em menores concentrações, tem um impacto significativo no aquecimento global.
Outro fator importante é que o óxido nitroso é um gás de vida longa, permanecendo na atmosfera por cerca de 114 anos antes de ser removido por processos naturais. Diante disso, vale ressaltar que a maior parte dele emitida na atmosfera provém de atividades humanas, e as principais fontes incluem:
-
Agricultura: a aplicação de fertilizantes nitrogenados no solo aumenta a disponibilidade de nitrogênio para bactérias do solo, que produzem N2O como subproduto por meio dos processos de nitrificação e desnitrificação.
-
Indústria: certos processos industriais, como a produção de ácido nítrico e a queima de combustíveis fósseis, também emitem N2O.
-
Tratamento de resíduos: a gestão de resíduos sólidos e de águas residuais pode liberar N2O devido à decomposição de matéria orgânica em condições anaeróbicas.
Quais riscos o óxido nitroso apresenta?
Os riscos que o óxido nitroso apresenta estão associados principalmente pelo contato e exposição direta, o que gera um perigo para a saúde e o meio ambiente, especialmente quando não é usado de forma adequada. Sendo assim, destacamos alguns casos a serem considerados:
-
Quando inalado de forma descontrolada, pode causar tontura, sonolência, confusão, náuseas, vômitos e perda de consciência.
-
Uso prolongado pode levar a problemas neurológicos e anemia por deficiência de vitamina B12.
-
Dentistas e anestesistas expostos ao gás podem sofrer efeitos adversos no longo prazo.
-
O uso recreativo como “gás do riso” pode causar asfixia e efeitos adversos à saúde.
Saiba mais: Qual a relação entre os óxidos e o efeito estufa?
Quais são os impactos que o óxido nitroso causa?
→ Impactos do óxido nitroso na saúde humana
Em virtude de seus efeitos negativos, o óxido nitroso apresenta diversos impactos significativos à saúde. Por exemplo, a inalação excessiva do gás que pode causar problemas respiratórios, como hipoxia, devido à substituição do oxigênio nos pulmões; ou simplesmente pode provocar problemas neurológicos, incluindo danos aos nervos periféricos; além de aumentar a frequência cardíaca e a pressão arterial, levando a problemas cardiovasculares.
→ Impactos do óxido nitroso no meio ambiente
Já no ambiente, ele pode agravar as condições climáticas globais, além de participar de reações químicas na estratosfera que podem modificar a composição química dessa camada. Sendo assim, as emissões desse gás podem influenciar negativamente os ecossistemas terrestres e aquáticos, alterando ciclos biogeoquímicos essenciais. Ademais, o uso intensivo de fertilizantes nitrogenados na agricultura pode levar à lixiviação de nitrogênio, contaminando o solo e os corpos d'água adjacentes, afetando a biodiversidade local e a qualidade dos recursos hídricos.
Fontes
ANDRÉ PERES SILVA, T.; SILVA, I. A. P. S.; ANDRADE, R. S. DE. Sedação inalatória com óxido nitroso na prática clínica odontológica. Brazilian Journal of Implantology and Health Sciences, v. 5, n. 5, p. 2740–2764, 2023.
DAVIDSON, L. T. Recreational use of nitrous oxide causes seizure, pneumothorax, pneumomediastinum, and pneumopericardium: nitrous oxide and its harm, a case report. Upsala Journal of Medical Sciences, v. 128, 2023.
EINSIEDLER, M. et al. A rise in cases of nitrous oxide abuse: neurological complications and biological findings. Journal of Neurology, v. 269, n. 2, p. 577–582, 2022.
FREING, A.; WALLACE, D. W. R.; BANGE, H. W. Global oceanic production of nitrous oxide. Philosophical Transactions of the Royal Society B: Biological Sciences, v. 367, n. 1593, p. 1245–1255, 2012.
GARZÓN, J. E.; CÁRDENAS, E. A. Emisiones Antropogénicas De Amoniaco, Nitratos Y Óxido Nitroso : Compuestos Nitrogenados Que Afectan El Medio Ambiente En El Sector Agropecuario Colombiano Anthropogenic Emissions of Ammonia, Nitrates and Nitrous Oxide : Nitrogen Compounds That Affect T. Rev. Med. Vet. Zoot., v. 60, n. Ii, p. 121–138, 2013.
JONES, C. M. et al. The unaccounted yet abundant nitrous oxide-reducing microbial community: A potential nitrous oxide sink. ISME Journal, v. 7, n. 2, p. 417–426, 2013.
KHINDA, V.; RAO, D.; SODHI, S. P. S. Nitrous Oxide Inhalation Sedation Rapid Analgesia in Dentistry: An Overview of Technique, Objectives, Indications, Advantages, Monitoring, and Safety Profile. International Journal of Clinical Pediatric Dentistry, 2023.
KOU-GIESBRECHT, S.; MENGE, D. N. L. Nitrogen-fixing trees increase soil nitrous oxide emissions: a meta-analysis. Ecology, v. 102, n. 8, 2021.
OLESEN, J. E. et al. Challenges of accounting nitrous oxide emissions from agricultural crop residues. Global Change Biology, v. 29, n. 24, p. 6846–6855, 2023.
REES, A. P. et al. Nitrous oxide and methane in a changing Arctic Ocean. Ambio, v. 51, n. 2, p. 398–410, 2022.
SIGNOR, D.; CERRI, C. E. P. Emissões de óxido nitroso em solos agrícolas: uma revisão. Pesquisa Agropecuária Tropical, 2013.
VAN AMSTERDAM, J.; VAN DEN BRINK, W. Nitrous oxide–induced reproductive risks: Should recreational nitrous oxide users worry? Journal of Psychopharmacology, v. 36, n. 8, p. 951–955, 2022.
VAN DIJK, E. J. H.; VAN LOOSDRECHT, M. C. M.; PRONK, M. Nitrous oxide emission from full-scale municipal aerobic granular sludge. Water Research, 2021.


