Reagente em excesso e reagente limitante

Segundo a Lei Ponderal de Proust, denominada de Lei das Proporções Constantes, as reações sempre ocorrem em proporções definidas e constantes. Por exemplo, a reação de formação da amônia é realizada na proporção de 1 mol de gás nitrogênio para 3 mols de gás hidrogênio, conforme mostrado pelos coeficientes estequiométricos na equação abaixo:
1 N2(g) + 3 H2(g) → 2 NH3(g)
Se essa reação for realizada numa proporção diferente dessa, então teremos um reagente em excesso e um reagente limitante. No caso de reagirmos 1 mol de N2(g) com apenas 2 mols de H2(g), veremos claramente que a quantidade de hidrogênio é menor do que a requerida pela relação estequiométrica, então ele é o reagente limitante da reação.
Reagente limitante é aquele que limita a quantidade de produto que pode ser produzido na reação. Isso significa que quando o reagente limitante é totalmente consumido, a reação para, mesmo tendo ainda outros reagentes.
Todos os outros reagentes que sobrarem são considerados reagentes em excesso.
Para entender isso, vamos fazer uma analogia: imagine que temos que montar todos os conjuntos possíveis entre parafusos e duas porcas. Digamos que temos 5 parafusos e 12 porcas. Nesse caso, os parafusos atuam como os reagentes limitantes e as porcas como os reagentes em excesso, porque iremos parar de montar os conjuntos quando os parafusos acabarem e irão sobrar ainda duas porcas.
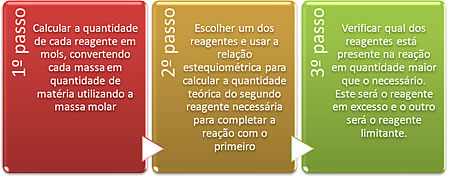
Para resolver questões que envolvem reagentes limitantes e em excesso, podemos seguir as três etapas mostradas abaixo:
Vejamos um exemplo:
Considere a seguinte reação corretamente balanceada:
6 Na(l) + Al2O3(s) → 2 Al(l) + 3 Na2O(s)
a) Determine o reagente limitante e o reagente em excesso dessa reação quando 5,52g de sódio reage com 5,10 g de Al2O3.
b) Qual é a massa de alumínio produzida?
c) Qual é a massa do reagente em excesso que permanecerá sem reagir no final do processo?
Resolução:
a) Vamos seguir os três passos citados para resolver a letra “a”:
1º Passo:
6 Na(l) + Al2O3(s) → 2 Al(l) + 3 Na2O(s)
A massa molar do Na é 23 g/mol e do Al2O3 é 102 g/mol. Determinando a quantidade em mols (n) de cada reagente:
n = m/MM
nNa = 5,52g / 23 g/mol → nNa = 0,24 mol
nAl2O3= 5,10g / 102 g/mol → nAl2O3 = 0,05 mol
2º Passo:
Fazer a relação estequiométrica para descobrir a quantidade de Al2O3 necessária para reagir com 0,24 mol de Na:
6 Na(l) + Al2O3(s) → 2 Al(l) + 3 Na2O(s)
6 mol ----- 1 mol
0,24 mol---- x
x = 0,04 mol
3º Passo:
O cálculo anterior mostrou que seria necessário 0,04 mol de Al2O3 para reagir totalmente com 0,24 mol de Na. Mas, o 1º passo mostrou que na verdade temos uma massa maior do que essa, que é de 0,05 mol de Al2O3. Assim, o Al2O3(s) é o reagente em excesso e o Na é o reagente limitante.
b) Para saber qual é a massa de alumínio produzida, basta relacionar com a quantidade do reagente limitante que temos, isto é, do sódio:
6 Na(l) + Al2O3(s) → 2 Al(l) + 3 Na2O(s)
6 mol de Na ---- 2 mol de Al
6 mol . 23 g/mol de Na ----- 2 mol . 27 g/mol de Al
138 g de Na ---- 54 g de Al
5,52 g de Na ---- y
y = 54 . 5,52
138
y = 2,16 g de Al serão produzidos.
c) Para saber a massa de reagente em excesso (Al2O3) que irá sobrar, basta diminuir a quantidade que foi colocada para reagir no início pela quantidade que de fato reagiu:
0,05 mol ----- 5,10 g
0,04 mol ---- w
w = 0,04 . 5,10
0,05
w = 4,08 g de Al2O3 reagiram
5,10 – 4,08 = 1,02 g de Al2O3 restaram.
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















