Solução saturada
Uma solução saturada ocorre quando um determinado solvente (material que dissolve outro) dissolve o máximo de soluto que é capaz de dissolver, e seu aspecto pode ser homogêneo ou heterogêneo.
Para determinar se a solução é saturada, é fundamental conhecer o coeficiente de solubilidade, ou seja, a quantidade máxima de soluto que um solvente consegue dissolver a uma determinada temperatura.
Exemplo: Uma solução foi preparada com a adição de 32 g de nitrato de potássio (KNO3) a 100 gramas de água, a uma temperatura de 20 oC. Para determinar se essa solução é saturada, é importante conhecer o coeficiente de solubilidade desse sal em água.
Com 100 g de água, a 20 oC, consegue-se a dissolução máxima, ou seja, torna-se saturada, com 32 g de KNO3. Portanto, a solução preparada com 32 g de KNO3 é saturada. Visualmente, teríamos uma mistura totalmente homogênea, assim, veríamos apenas a água, pois todo o KNO3 estaria dissolvido.
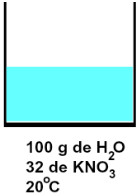
Representação de uma solução saturada de KNO3
Se prepararmos uma solução adicionando 50 gramas de KNO3 a 100 gramas de água, a 20 oC, também obteremos uma solução saturada, pois a água, a essa temperatura, dissolve 32 gramas dos 50 adicionados. Porém, não teríamos uma mistura homogênea, já que a água não seria capaz de dissolver 18 gramas de KNO3.
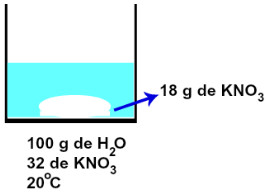
Solução saturada contendo excesso de KNO3
Na imagem acima, podemos observar que a parte do soluto não dissolvida pelo solvente foi deslocada para o fundo, por ser mais densa. Como essa solução saturada apresenta mais de uma fase, deve ser chamada de solução saturada com precipitado, ou solução saturada com corpo de fundo.
Outro exemplo da obtenção de solução saturada é o preparo do café. A prova disso é que devemos passar a mistura pelo coador ou pelo filtro de papel para retirar o excesso de café transformado em corpo de fundo.

No preparo do café, sempre se forma uma solução saturada
Vale ressaltar que, quando o solvente dissolve uma quantidade de soluto menor que o limite, a solução passa a ser denominada de insaturada.
Acompanhe agora alguns exemplos de exercícios que envolvem soluções saturadas:
1º Exemplo: (UEM-PR) Um determinado sal X apresenta solubilidade de 12,5 gramas por 100 mL de água a 20 ºC. Imagine que quatro tubos contêm 20 mL de água cada e que as quantidades a seguir do sal X foram adicionadas a esses tubos:
Tubo 1: 1,0 grama;
Tubo 2: 3,0 gramas;
Tubo 3: 5,0 gramas;
Tubo 4: 7,0 gramas.
Após agitação, mantendo-se a temperatura a 20 ºC, coexistirão solução saturada e fase sólida no(s) tubo(s)
a) 1.
b) 3 e 4.
c) 2 e 3.
d) 2, 3 e 4.
e) 2.
Dados do exercício:
Coeficiente de solubilidade: 100 mL de água dissolvem 12,5 g do soluto X;
Quatro tubos, e cada um com 20 mL de água;
Tubo 1: contém 1 g do soluto X;
Tubo 2: contém 3 g do soluto X;
Tubo 3: contém 5 g do soluto X;
Tubo 4: contém 7 g do soluto X.
Inicialmente, devemos compreender que, em cada tubo, o autor adicionou apenas 1/5 da quantidade de água do coeficiente de solubilidade, logo, os 20 mL utilizados conseguem dissolver 5 vezes menos que os 100 mL, ou seja, 20 mL de água dissolvem apenas 2,5 g do soluto X. Assim:
-
Tubo 1: os 20 mL dissolvem totalmente 1 g de X e conseguiria dissolver ainda 1,5 g. Portanto, nesse tubo, temos uma solução insaturada.
-
Tubo 2: os 20 mL dissolvem totalmente apenas 2,5 g dos 3 g de X que estavam no recipiente, sobrando, assim, 0,5 g de X no fundo do recipiente. Por essa razão, temos nesse tubo uma solução saturada com corpo de fundo.
-
Tubo 3: os 20 mL dissolvem totalmente apenas 2,5 g dos 5 g de X que estavam no recipiente, sobrando, assim, 2,5 g de X no fundo do recipiente. Portanto, temos nesse tubo uma solução saturada com corpo de fundo.
-
Tubo 4: os 20 mL dissolvem totalmente apenas 2,5 g dos 7 g de X que estavam no recipiente, sobrando, assim, 4,5 g de X no fundo do recipiente. Portanto, temos nesse tubo uma solução saturada com corpo de fundo.
O exercício solicita quais as misturas em que coexistem fases líquida e sólida, que são encontradas nos tubos 2, 3 e 4.
2º Exemplo: (Uespi) Quando adicionamos sal comum (NaCl) à água, sob agitação e temperatura constantes, verificamos que, em dado momento, o sal não se dissolve mais. No caso do NaCl, isso ocorre quando há, aproximadamente, 360 g de sal por 1000 mL de água. Se adicionarmos 500 g de NaCl em 1000 mL de água, nas mesmas condições acima, estaremos preparando uma solução que será classificada como uma:
a) solução saturada sem sal precipitado.
b) solução saturada com sal precipitado.
c) solução supersaturada.
d) solução insaturada.
e) solução supersaturada instável.
O exercício informa que 1000 mL de água consegue dissolver, no máximo, 360 g, a uma dada temperatura, ou seja, é a quantidade de sal que satura a água. Porém, informa que, em vez de 360 g, serão adicionados 500 g de sal em 1000 mL de água.
Ao adicionar 500 g de sal em 1000 mL de água, 360 g serão dissolvidos, e 140 g deverão ser deslocados para o fundo, formando, assim, uma solução saturada com precipitado.

