Velocidade instantânea em uma reação química

Conforme dito no texto “Cálculo da Velocidade Média de uma Reação” (), a velocidade média de uma reação química pode ser calculada pela variação da quantidade de reagentes ou pela variação da quantidade de produtos dividida pelo intervalo de tempo, conforme as fórmulas matemáticas:
Vm = - Δ [reagentes] ou Vm = Δ [produtos]
Δt Δt
No entanto, é possível também calcular a velocidade instantânea para uma reação. Essa velocidade ou rapidez instantânea é a rapidez da reação em determinado instante. Podemos, então, calcular a velocidade em um determinado momento da reação ou em uma determinada concentração dos reagentes ou dos produtos.
Para você entender a diferença entre a velocidade média e a velocidade instantânea, pense, por exemplo, em uma viagem de carro. No instante inicial da viagem, ou seja, no instante zero segundo, o carro está parado, portanto, sua velocidade instantânea é igual a zero. Digamos que o carro então comece a andar e depois de 15 minutos ele ultrapasse o km 30 da rodovia com uma velocidade igual a 120 km/h. Parando no pedágio, depois de 20 minutos de viagem, sua velocidade passa a 20 km/h e, por fim, depois de 75 minutos, ele chega à cidade de destino com uma velocidade de 100 km/h.
Se quiséssemos calcular a velocidade média dessa viagem, bastaria dividir a variação de espaço percorrido pela variação do tempo:
Vm = Δs = 100 km = 100 km = 80 km/h
Δt 75 min 1,25 h
Veja que a velocidade média foi igual a 80 km/h, no entanto isso não significa que em todos os instantes da viagem a velocidade tenho sido essa. Como vimos, em cada instante da viagem havia uma velocidade instantânea específica.
O mesmo ocorre com as reações químicas: a rapidez da reação química muda no decorrer do processo; assim, a rapidez média é diferente da rapidez instantânea.
Além disso, se considerarmos intervalos de tempo muito pequenos, a rapidez média se torna cada vez mais próxima ao valor da rapidez instantânea.
Mas, então, como é feito o cálculo da velocidade instantânea?
Isso é realizado por meio do gráfico de variação de concentração pelo tempo. Primeiro calcula-se a velocidade média entre dois pontos que estejam próximos. Depois, deve-se construir um triângulo retângulo relacionando esses pontos. Desse modo, a tangente do ângulo (α) será aproximadamente o valor da velocidade instantânea nesse ponto, conforme a fórmula abaixo:
tg α = cateto oposto
cateto adjacente
Ou seja, aplicando essa fórmula no gráfico, temos que o cateto oposto será dado pela variação da concentração e o cateto adjacente será o intervalo de tempo. Assim, temos:

Deve-se estar atento para o fato de que às vezes não se relaciona a concentração com o tempo, mas podem ser relacionados com o tempo: a massa, o número de mol, o volume, etc. Assim, o cateto oposto será a variação da grandeza física dada.
Veja um exemplo de como isso é realizado: considere a reação química de decomposição do pentóxido de dinitrogênio em óxido de nitrogênio e gás oxigênio mostrada abaixo:
2 N2O5(g) → 4 NO2(g) + 1 O2(g)
A seguir temos o gráfico da variação da concentração em mol/L do N2O5 e dos produtos NO2 e O2:
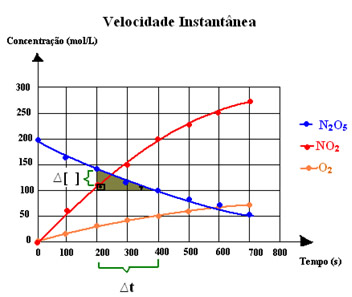
Como faríamos para calcular a velocidade instantânea para o N2O5 no instante t = 300 s?
Bem, primeiro calcula-se a rapidez média entre dois pontos próximos, por exemplo, entre 200 s e 400 s. Um fator importante é que quanto mais próximos forem os pontos, mais a velocidade instantânea se aproxima da média. Assim, temos:
Vm = Δ[ final – inicial ] = (149- 108) mol/ L =41 mol/L = 0,205 mol/L . s
Δ[ tfinal – tinicial ] (400-200) s 200 s
tg α = Δ (N2O5) = rapidez instantânea
Δ (tempo)
Portanto, a rapidez instantânea será aproximadamente 0,205 mol/L . s no instante t = 300 s.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias