Cálculo da constante de equilíbrio Kp

Antes de ler este texto, se você tiver quaisquer dúvidas sobre o que é a constante de equilíbrio Kp e sobre como escrever a sua expressão para reações em equilíbrio, leia o texto Constante de equilíbrio Kp.
Tendo essas informações esclarecidas, agora vamos aprender como calcular o valor de Kp. Geralmente, os passos necessários para tal são:
1º) Determinar a fração molar (x) de cada gás;
2º) Determinar as pressões parciais de cada gás;
3º) Substituir os valores das pressões parciais na expressão de Kp.
A fração molar (x) de cada gás é dada pela fórmula:
xgás = ngás
ntotal
Sendo que “n” é o número em quantidade de matéria (mol). Esse passo é necessário porque, conforme explicado no texto Pressão parcial (Lei de Dalton), a lei das pressões parciais criada por Dalton estabelece que “a pressão total do sistema corresponde à soma das pressões parciais exercidas por cada um dos gases que compõem a mistura (Ptotal = P1 + P2 + P3 + P4… ou P = Σp)”. Essa lei diz também que “essa pressão exercida pela mistura gasosa está diretamente relacionada com a quantidade de partículas de cada gás”. Por isso, temos para um determinado gás:
Pgás = ngás
Ptotal ntotal
ou
Pgás = xgás → Pgás =Ptotal . xgás
Ptotal
Consideremos um exemplo:
Em um cilindro dotado de êmbolo, como esquematizado abaixo, há vários gases em equilíbrio à temperatura constante. A pressão parcial do sistema é 10 atm, e a temperatura, 24ºC. Determine a constante de equilíbrio (Kp) para o sistema no sentido considerado. (Dado: 0,082 atm . L . K-1 . mol-1).
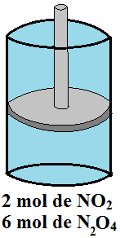
Cilindro com êmbolo em exercício sobre constante de equilíbrio (Kp)
Resolução:
Considerando os dois gases acima, temos a seguinte reação em equilíbrio
N2O4(g) ↔ 2 NO2(g)
Sua expressão da constante de equilíbrio, em termos de pressões parciais, é:
Kp = (pNO2)2
pN2O4
Vamos, então, seguir os três passos indicados mais acima:
1º) Determinar a fração molar (x) de cada gás:
xN2O4 = nN2O4 xNO2 = nNO2
ntotal ntotal
xN2O4 = 6 mol xNO2 = 2 mol
8 mol 8 mol
xN2O4 = 0,75 xNO2 = 0,25
2º) Determinar as pressões parciais de cada gás:
Conforme a Lei de Dalton, temos:
PN2O4 = Ptotal . xN2O4 PNO2 = Ptotal . xNO2
PN2O4 = 10 . 0,75 PNO2 = 10 . 0,25
PN2O4 = 7,5 atm PNO2 = 2,5 atm
3º) Substituir os valores das pressões parciais na expressão de Kp:
Kp = (pNO2)2
pN2O4
Kp = (2,5)2
7,5
Kp = 6,25
7,5
Kp = 0,83
A constante de equilíbrio (Kp) para o sistema no sentido considerado, a 24 ºC, é de 0,83.



