Ácido sulfúrico
O ácido sulfúrico é um composto essencial na produção de fertilizantes, sendo responsável por grande parte da produtividade agrícola mundial. Devido às suas diversas aplicações em setores industriais, ele é considerado um dos pilares da Química moderna.
Sua produção em larga escala não se restringe à fabricação de fertilizantes, abrangendo produtos químicos, baterias e refino de petróleo. Isso o torna indispensável para o desenvolvimento econômico e tecnológico.
Apesar de ser um indicador do nível de industrialização de um país, ele também apresenta desafios significativos devido à sua natureza corrosiva e aos impactos ambientais que pode causar.
Leia também: Características e propriedades gerais dos ácidos
Resumo sobre o ácido sulfúrico
- O ácido sulfúrico um composto químico inorgânico, líquido, viscoso e incolor classificado como um oxiácido.
- É um ácido forte e corrosivo, utilizado em diversas indústrias para a produção de fertilizantes, produtos químicos e o refino de petróleo.
- Sua obtenção é feita principalmente pelo processo de contato, que envolve a oxidação do dióxido de enxofre para formar trióxido de enxofre, seguido pela absorção em ácido sulfúrico.
- Ele apresenta perigos significativos, como queimaduras químicas e danos ao meio ambiente, exigindo cuidados rigorosos no manuseio e armazenamento.
- Pode causar dano ao solo, afetando vegetação e microbiota.
- Pode contribuir para a poluição atmosférica e formação da chuva ácida.
- Pode apresentar reatividade com outros poluentes, formando compostos tóxicos.
- Foi descrito, pela primeira vez, por Jabir ibn Hayyan no século VIII.
- Teve o método industrial aprimorado por John Roebuck e Clement Winkler com os processos das câmaras de chumbo e de contato.
O que é ácido sulfúrico?
O ácido sulfúrico é um composto químico inorgânico classificado como um oxiácido (contém oxigênio) e considerado um dos ácidos mais fortes. É amplamente utilizado na indústria.
Para que serve o ácido sulfúrico?
O ácido sulfúrico tem diversas aplicações, principalmente no contexto da indústria, sendo uma das substâncias mais utilizadas nesse setor. Tem como suas principais finalidades:
- É essencial na fabricação de fertilizantes, como o superfosfato e o sulfato de amônio, importantes para a agricultura.
- É usado no processo de refino de petróleo para remover impurezas, como enxofre, e melhorar a qualidade dos derivados de petróleo, como gasolina e diesel.
- Serve como reagente na produção de uma variedade de produtos químicos, incluindo ácidos, corantes, detergentes, explosivos e fármacos.
- É um componente vital no eletrólito de baterias de automóveis, em que participa das reações que geram energia elétrica.
- É utilizado em processos de decapagem, removendo oxidações e impurezas de superfícies metálicas e preparando-as para pintura ou revestimento.
- Participa de reações de hidrólise, de desidratação e como catalisador em diversas reações químicas industriais.
Leia também: Ácido nítrico — o ácido utilizado na produção de explosivos
Propriedades do ácido sulfúrico
-
- Densidade: aproximadamente 1,84 g/cm3.
- Ponto de ebulição: cerca de 337 °C.
- Ponto de fusão: 10,4 °C.
- Solubilidade: é altamente solúvel em água, mas essa mistura deve ser feita com cuidado, adicionando o ácido à água lentamente, pois a reação é altamente exotérmica (libera muito calor).
- Condutividade: soluções de ácido sulfúrico conduzem eletricidade, pois ele ioniza completamente em água, liberando íons H+ e SO42-.
Características do ácido sulfúrico
Entre as características do ácido sulfúrico, a mais conhecida é o fato de ele ser considerado um ácido forte, o que significa que ele se dissocia completamente em solução aquosa, liberando uma grande quantidade de íons H⁺, responsáveis por seu caráter altamente ácido. Podemos citar, ainda, estas características:
- É um líquido denso e espesso que pode parecer oleoso ao toque.
- Quando puro, é transparente e incolor, embora soluções mais concentradas possam apresentar uma coloração amarelada devido à presença de impurezas.
- Tem uma capacidade intensa de corroer metais, tecidos e outras substâncias.
- Ao ser diluído em água, libera uma grande quantidade de calor (reação exotérmica), o que pode causar fervura violenta se não for feito de forma controlada.
- Tem forte capacidade de retirar água de substâncias orgânicas, podendo até carbonizar materiais, como açúcar ou papel.
- Reage com bases para formar sais chamados sulfatos, como o sulfato de sódio (Na2SO4).
- É altamente higroscópico, ou seja, atrai e absorve umidade do ar, o que pode concentrar a solução e torná-la ainda mais corrosiva.
- Em concentrações elevadas, pode atuar como agente oxidante, promovendo a oxidação de outras substâncias, especialmente em reações com compostos orgânicos.
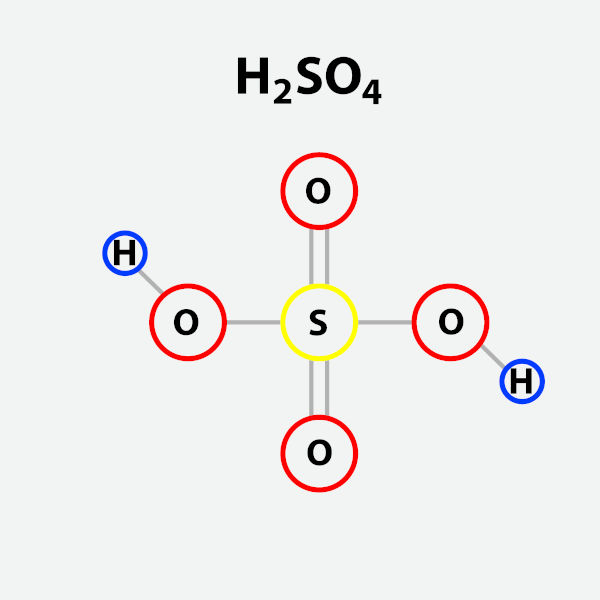
Fórmula do ácido sulfúrico
O ácido sulfúrico é composto por dois átomos de hidrogênio, um de enxofre e quatro de oxigênio. Apresentando as seguintes fórmulas química e estrutural:
Obtenção do ácido sulfúrico
Quanto à obtenção do ácido sulfúrico, ela é feita principalmente pelo processo de contato, ilustrado abaixo:
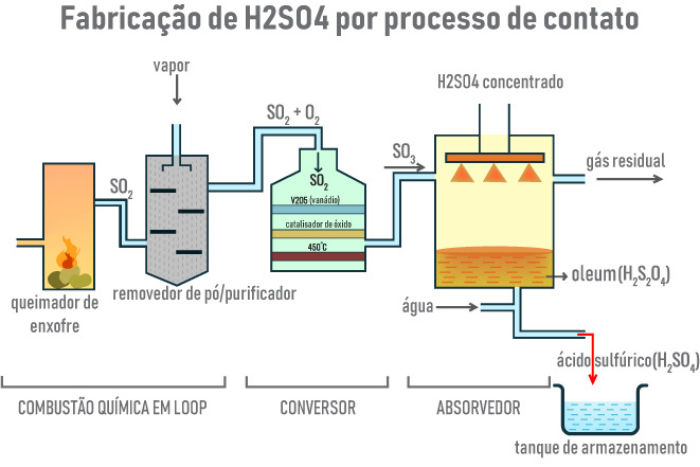
Esse processo é amplamente utilizado devido à sua eficiência e capacidade de produção em larga escala, e envolve as seguintes etapas:
- Produção de dióxido de enxofre (SO2): o processo começa com a queima de enxofre elementar ou pirita (FeS2) em presença de oxigênio, gerando dióxido de enxofre (SO2).
- Oxidação do SO2 para trióxido de enxofre (SO3): o dióxido de enxofre é então conduzido a um conversor, no qual passa por catalisadores de óxido de vanádio (V2O5) em altas temperaturas (cerca de 450 °C). Nessa etapa, o SO2 é oxidado a trióxido de enxofre (SO3).
- Absorção do SO3 em ácido sulfúrico: o trióxido de enxofre produzido é absorvido em ácido sulfúrico concentrado (H2SO4), formando o oleum (H2S2O7), uma solução de SO3 em ácido sulfúrico.
- Diluição do oleum: por fim, o oleum é cuidadosamente diluído com água para formar ácido sulfúrico em diferentes concentrações, conforme a necessidade.
Perigos do ácido sulfúrico
Dado a sua natureza corrosiva e a sua reatividade, visto que é um ácido forte, o ácido sulfúrico apresenta vários perigos, sobretudo ao meio ambiente, especialmente se não for manuseado e descartado adequadamente. Em vista disso, podemos citar motivos de preocupação como:
- Contaminação da água: se liberado em corpos d´água, pode acidificar rios, lagos e fontes subterrâneas, prejudicando a vida aquática. A acidez elevada pode causar a morte de peixes e outros organismos, além de comprometer a qualidade da água para consumo humano e animal.
- Dano ao solo: o derramamento de ácido sulfúrico no solo pode acidificar o ambiente, destruindo a vegetação e afetando negativamente a microbiota do solo, essencial para a fertilidade e a saúde do ecossistema, o que pode resultar em erosão e perda de capacidade produtiva da terra.
- Poluição atmosférica: durante a produção ou em caso de vazamentos, o ácido sulfúrico pode formar névoas ácidas, que contribuem para a poluição do ar. Essas névoas podem causar chuva ácida, que danifica plantas, corrói estruturas e prejudica ecossistemas.
Ademais, quando em contato com outros poluentes ou substâncias químicas presentes no ambiente, ele pode reagir, formando compostos ainda mais tóxicos e perigosos para a saúde ambiental.
Efeitos do ácido sulfúrico no organismo
Uma vez que o ácido sulfúrico é extremamente corrosivo, ele pode causar graves danos ao nosso organismo, de modo que seus efeitos variam dependendo da via de exposição. Sendo assim, podemos destacar:
- Contato com a pele: causa queimaduras químicas severas, com dor intensa, vermelhidão e necrose dos tecidos. A exposição prolongada pode resultar em cicatrizes permanentes.
- Contato com os olhos: pode levar a queimaduras graves, danos à córnea e até cegueira dependendo da concentração e do tempo de exposição.
- Inalação: a inalação de vapores ou névoas pode irritar gravemente as vias respiratórias, causando tosse, dificuldade para respirar e, em casos graves, edema pulmonar.
- Ingestão: a ingestão acidental provoca queimaduras na boca, esôfago e estômago, resultando em dor intensa, vômitos com sangue e danos internos graves, que podem ser fatais.
Leia também: Monóxido de carbono — o gás que pode causar intoxicação por asfixia química
Importância do ácido sulfúrico
A importância do ácido sulfúrico é consolidada no âmbito industrial e econômico, sendo um dos produtos químicos mais produzidos e utilizados no mundo. Por conta disso, a sua produção é frequentemente usada como indicador do nível de desenvolvimento industrial de um país, já que ele se destaca na produção de fertilizantes, cruciais para a agricultura e, consequentemente, para a segurança alimentar global.
Além disso, sua relevância na indústria química é reforçada pela sua aplicação na fabricação de baterias de chumbo-ácido, amplamente utilizadas em veículos, e no refino de petróleo, o qual sustenta a produção de combustíveis e outros derivados.
História do ácido sulfúrico
A história do ácido sulfúrico remonta à Idade Média, quando os alquimistas começaram a investigar substâncias químicas. Inicialmente ele era conhecido como “óleo de vitríolo”, e foi descrito pela primeira vez pelo alquimista árabe Jabir ibn Hayyan no século VIII. Ele o obteve aquecendo minerais como o sulfato de ferro (vitríolo verde) e o sulfato de cobre (vitríolo azul). Já no século XV, o alquimista europeu Basílio Valentim também descreveu a produção do ácido por meio do aquecimento de minerais de sulfato.
Por sua vez, no século XVII, o químico alemão Johann Rudolf Glauber começou a produzi-lo em maior escala ao queimar enxofre com nitrato de potássio (salitre). No século XVIII, o químico britânico John Roebuck desenvolveu o primeiro método industrial para a produção de ácido sulfúrico, conhecido como processo das câmaras de chumbo.
Nesse processo eram usadas câmaras revestidas de chumbo para suportarem a corrosividade do ácido. Contudo, esse método foi substituído, no final do século XIX, pelo processo de contato, desenvolvido pelo químico alemão Clement Winkler e utilizado até hoje por sua eficiência e maior pureza do produto final.
Fontes
ASHAR, N. G.; GOLWALKAR, K. R. Processes of Manufacture of Sulfuric Acid. In: A Practical Guide to the Manufacture of Sulfuric Acid, Oleums, and Sulfonating Agents. Cham: Springer International Publishing, 2013. p. 9–30.
CAMPOS, V. R. Sulfuric acid (CAS No. 7664-93-9). Revista Virtual de Quimica, v. 3, n. 3, p. 210–214, 2011.
FELTRE, R. Ácidos importantes. In: Química Geral. 6. ed. São Paulo: Moderna, 2004. v. 1p. 194.
HODGE, C. A. Sulfuric Acid Production. In: Pollution Control in Fertilizer Production. [s.l.] CRC Press, 1994. p. 177–202.
JIANG, A. et al. Sulfuric Acid Burns. In: Kanerva’s Occupational Dermatology. Cham: Springer International Publishing, 2020. p. 2587–2593.
MULLER, T. L. Sulfuric Acid and Sulfur Trioxide. In: Kirk-Othmer Encyclopedia of Chemical Technology. [s.l.] Wiley, 2006.
PALMER, A. N.; HILL, C. A. Sulfuric acid caves. In: Encyclopedia of Caves. [s.l.] Elsevier, 2019. p. 1053–1062.


