Ácidos
Os ácidos estão presentes em vários momentos do nosso cotidiano, desde o ácido cítrico, presente no suco de laranja que tomamos, até o ácido clorídrico do suco gástrico, presente no nosso estômago, que utilizamos no processo da digestão. Quimicamente falando, ácidos são, segundo a teoria do químico sueco Svante Arrhenius, toda substância que, em solução aquosa, origina como único cátion o H+.
Saiba mais: Teorias ácido-base de Arrhenius, de Brønsted-Lowry e de Lewis
Características
Para muitos a palavra ácido pode significar um líquido corrosivo extremamente perigoso. No entanto, nem todos os ácidos são assim, e muitos deles até fazem parte da nossa alimentação, como o ácido acético do vinagre.
Uma das características em comum dos ácidos é o sabor azedo, porém não devemos utilizar tal propriedade para identificá-los, pois ingerir substâncias desconhecidas pode ser muito perigoso e até letal.
Existem outras características que permitem a identificação de forma segura dos ácidos. Vejamos alguns exemplos:
- Possuem condutibilidade elétrica em soluções aquosas;
- Reagem com metais e produzem H2;
- Possuem pH inferior a 7;
- Normalmente são líquidos a temperatura ambiente.
Leia também: 6 tópicos fundamentais sobre ácidos no Enem
Classificação dos ácidos
Os ácidos podem ser classificados segundo alguns critérios:
1) Quanto à presença de oxigênio: Os ácidos são hidrácidos quando não possuem oxigênio em sua fórmula molecular. Exemplos: HF, HBr, HCN, H2S etc. Quando o oxigênio está presente na fórmula molecular do ácido, ele é chamado de oxiácido. Exemplos: H2SO4, HNO3, H2CO3, H3PO4 etc.
2) Quanto ao número de hidrogênios ionizáveis: Em função da quantidade de íons H+ liberados em água, os ácidos podem ser classificados da seguinte maneira:
- Monoácidos: liberam apenas 1 íon H+. Exemplos: HNO3 e HCN;
- Diácidos: liberam 2 íons H+. Exemplos: H2SO4 e H2S;
- Triácidos: liberam 3 íons H+. Exemplos: H3PO4 e H3BO3;
- Tetrácidos: liberam 4 íons H+. Exemplo: H4SiO4.
3) Quanto à força dos ácidos: A força de um ácido é medida com base em seu grau de ionização (α). Quanto maior o grau de ionização, mais forte será o ácido. A expressão matemática a seguir define o grau de ionização:
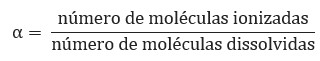
Conhecendo o grau de ionização do ácido, que é obtido de forma experimental, podemos classificá-lo em:
- Fortes: α ≥ 50%
- Moderados: 5% < α < 50%
- Fracos: α ≤ 5%
Quanto aos oxiácidos, podemos classificá-los segundo sua força determinando a diferença (x) entre a quantidade de oxigênios e a de hidrogênios ionizáveis:
X = número de O – número de H ionizáveis
Quando x = 2 ou 3, temos um ácido forte; para x = 1, ácido moderado; e para x = 0, ácido fraco.
Para aprofundar seus estudos a respeito do tema, leia: Classificação dos ácidos.
Potencial Hidrogeniônico (pH)
O potencial hidrogeniônico é uma escala usada para determinar a acidez e basicidade das soluções. Ela varia de 0 a 14, em que, para valores abaixo de 7, temos uma solução ácida, e para valores maiores de 7, as soluções são consideradas básicas. As soluções neutras possuem pH igual a 7.
Veja também: Conceito de pH e pOH
Para determinar o ph de uma solução, pode-se utilizar aparelhos de medidas chamados pHmetros, ou ainda indicadores, que mudam de cor de acordo com o caráter ácido ou básico da solução.

Ácidos no dia a dia
A seguir, citaremos os ácidos mais comuns e presentes no nosso cotidiano:
- Ácido acético: encontrado no vinagre;
- Ácido cítrico: encontrado em frutas cítricas, como laranja, limão e acerola;
- Ácido fosfórico: usado na fabricação de refrigerantes;
- Ácido carbônico: encontrado em bebidas gaseificadas em geral;

- Ácido clorídrico: presente no suco gástrico e usado, também, como produto de limpeza, sendo chamado de ácido muriático;
- Ácido sulfúrico: presente na chuva ácida e usado como eletrólito em baterias de automóveis.
Outros exemplos de ácidos:
- Ácido ascórbico (vitamina C);
- Ácido acetilsalicílico (AAS — aspirina);
- Ácido lático (presente no leite);
- Ácido cianídrico (usado em câmaras de gás);
- Ácido fórmico (presente nas formigas).
Exercícios resolvidos
Questão 01 (Unitau-SP) A ionização do ácido clorídrico na água produz:
a) cátion hidrogênio e ânion cloreto
b) ânion hidrogênio e cátion cloreto
c) cátion hidrogênio e ânion clorato
d) ânion hidreto e cátion cloroso
e) cátion hidrato e ânion clorito
Resolução: Letra A. A ionização do ácido clorídrico, HCl, é representada pela equação química a seguir:
HCl(aq) 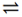 H+ + Cl-
H+ + Cl-
Ou seja, a ionização do ácido clorídrico produz cátion hidrogênio e ânion cloreto.
Questão 02 - (Mackenzie-SP) Um técnico químico preparou três soluções de ácidos diferentes (X, Y e Z), sob as mesmas condições de temperatura e pressão e com o mesmo volume de água, como ilustra a figura seguinte.
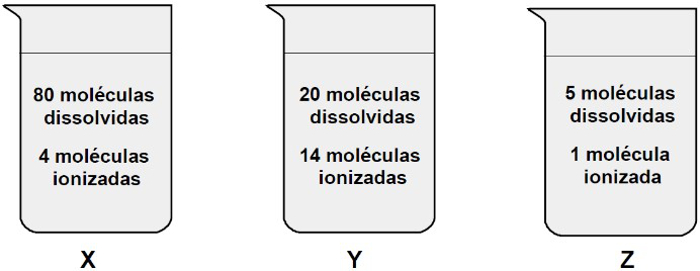
Dessa forma, são realizadas as seguintes afirmações.
I. A solução Y é a que apresenta a maior condutividade elétrica.
II. A solução Z possui um grau de ionização de apenas 0,2 %.
III. Das três soluções, a solução X representa o ácido mais fraco.
Sendo assim,
a) Está correta apenas a afirmação I.
b) Estão corretas apenas as afirmações I e II.
c) Estão corretas apenas as afirmações I e III.
d) Estão corretas apenas as afirmações II e III.
e) Estão corretas todas as afirmações.
Resolução: Letra C. Usando esta fórmula
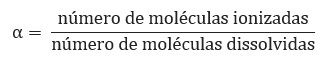
encontramos o grau de ionização de cada um dos ácidos:
αX = 5%
αY = 70%
αZ = 20%
E agora, julgamos os itens:
I – Verdadeiro, pois a solução Y possui maior grau de ionização e, portanto, a maior quantidade de íons em solução, permitindo uma melhor condutibilidade elétrica.
II – Falso, o grau de ionização da solução Z é igual a 20%.
III – Verdadeiro, das três soluções apresentadas, a solução X possui o menor grau de ionização e, portanto, é o ácido mais fraco.

