Cálculos relativos à mistura de soluções de mesmo soluto

Os cálculos relativos à mistura de soluções de mesmo soluto são utilizados para determinar a concentração comum ou em mol/L, principalmente, de uma solução final, formada a partir da mistura de duas ou mais soluções que apresentam o mesmo soluto e o mesmo solvente.
.jpg)
Representação de uma mistura de soluções de mesmo soluto
Quando uma mistura de soluções de mesmo soluto é realizada, temos como consequência um aumento do volume (V) e da massa do soluto, já que as soluções estão em um único recipiente. Na imagem acima, a somatória dos volumes resultou em 350 mL, e a somatória das massas do soluto (m1) resultou em 140 g. Logo:
Massa do soluto e volume nas misturas de mesmo soluto
Como temos soluto nas fórmulas de título (T), concentração em mol/L (M) e concentração comum (C), se o isolarmos, teremos:
Fórmulas para calcular as concentrações comum, título e em mol/L
Para realizar os cálculos relacionados à mistura de soluções de mesmo soluto, devemos partir do pressuposto que antes e após a mistura o soluto deve ser somado, já que as soluções apresentam a mesma substância dissolvida. Assim, as seguintes fórmulas podem ser utilizadas nesses cálculos:
Fórmulas mais utilizadas em cálculos de mistura de soluções de mesmo soluto
A seguir, alguns exemplos de aplicação dos cálculos relativos à mistura de soluções de mesmo soluto:
1º Exemplo - (UE-AM) 100 mL de uma solução aquosa contendo 10 g de sacarose (açúcar comum) dissolvidos foram misturados com 100 mL de uma solução aquosa contendo 20 g desse açúcar dissolvidos. A concentração de sacarose na solução obtida, expressa em porcentagem (m/V), é:
a) 5%.
b) 10%.
c) 15%.
d) 25%.
e) 30%.
Os dados fornecidos pelo exercício foram:
- Volume da solução 1 = 100 mL ou 0,1 L (depois de dividir por 1000)
- Massa do soluto na solução 1 = 10 g
- Volume da solução 2 = 100 mL ou 0,1 L (depois de dividir por 1000)
- Massa do soluto na solução 2 = 20 g
Os passos que devem ser seguidos são:
-
1º Passo: Calcular a massa na solução final.
Para isso, utilizar os dados da solução na expressão abaixo:
m1 (na solução 1) + m1 (na solução 2) = m1 (na solução final)
10 + 20 = m1 (na solução final)
30 g = m1 (na solução final)
-
2º Passo: Calcular o volume da solução final.
Para isso, basta somar os volumes das soluções misturadas:
VF = V1 + V2
VF = 100 + 100
VF = 200 mL
-
3º Passo: Calcular a concentração da solução 1.
Para isso, utilizar os dados da solução na expressão abaixo:
C = m1
V
C = 30
0,2
C = 150 g/L
-
4º Passo: Calcular a porcentagem da solução final.
Para calcular a porcentagem em massa, basta montar uma regra de três da seguinte forma:
150 g ------------ 1000 mL
x g ------------- 100 mL
1000.x = 100.150
x = 15000
1000
x = 15 %
2º Exemplo - (Uergs) O volume em litros de uma solução de HNO3 0,1 mol.L–1 que deve ser adicionado a 5 litros de uma solução de HNO3 0,5 mol.L–1 para obter uma concentração final igual a 0,2 mol.L–1 é
a) 3.
b) 6.
c) 12.
d) 15.
e) 30.
Os dados fornecidos pelo exercício foram:
-
Volume da solução 1 = ? L
-
Concentração em mol/L da solução 1 = 0,1 mol/L
-
Volume da solução 2 = 5 L
-
Concentração em mol/L da solução 2 = 0,5 mol/L
-
Concentração em mol/L da solução final: 0,2 mol/L
Os passos que devem ser seguidos são:
-
1º Passo: Calcular o volume da solução final.
Para isso, basta somar os volumes das soluções misturadas:
VF = V1 + V2
VF = V1 + 5
-
2º Passo: Determinar o volume da solução 1.
Para isso, basta empregar na fórmula abaixo os valores fornecidos e a expressão obtida no passo anterior:
M1.V1 + M2.V2 = MF.VF
0,1. V1 + 0,5.5 = 0,2.(V1 + 5)
0,1. V1 + 2,5 = 0,2. V1 + 1
0,2. V1 - 0,1. V1 = 2,5 – 1
0,1. V1 = 1,5
MF = 1,5
0,1
MF = 15 L
3º Exemplo - (UFF-RJ) A molaridade de uma solução X de ácido nítrico é o triplo da molaridade de outra solução Y do mesmo ácido. Ao se misturar 200,0 mL da solução X com 600,0 mL da solução Y, obtém-se uma solução 0,3 M do ácido. Pode-se afirmar, então, que as molaridades das soluções X e Y são, respectivamente:
a) 0,60 M e 0,20 M
b) 0,45 M e 0,15 M
c) 0,51 M e 0,17 M
d) 0,75 M e 0,25 M
e) 0,30 M e 0,10 M
Os dados fornecidos pelo exercício foram:
-
Volume da solução 1 = 200 mL
-
Concentração em mol/L da solução 1 = 3.x
-
Volume da solução 2 = 600 mL
-
Concentração em mol/L da solução 2 = x mol/L
-
Concentração em mol/L da solução final: 0,3 M ou mol/L
Os passos que devem ser seguidos são:
-
1º Passo: Calcular o volume da solução final.
Para isso, basta somar os volumes das soluções misturadas:
VF = V1 + V2
VF = 200 + 600
VF = 800 mL
-
2º Passo: Determinar a concentração da solução 2 (que é o x).
Para isso, devemos empregar na fórmula abaixo os valores fornecidos e a expressão obtida no passo anterior:
M1.V1 + M2.V2 = MF.VF
3x. 200 + x.600 = 0,3.800
600x + 600x = 240
1200x = 240
x = 240
1200
x = 0,2 M ou mol/L
-
3º Passo: Determinar a concentração da solução 1.
Como a concentração da solução 1 é o triplo da solução 2, sua concentração será, portanto, de 0,6 M ou mol/L.
4º Exemplo - (UEL-PR) Esta questão relaciona-se com a solução obtida pela mistura de 200 mL de 0,50 M de HNO3 e 300 mL de solução 0,20 M do mesmo ácido. A solução final tem concentração molar
a) 0,50
b) 0,32
c) 0,25
d) 0,20
e) 0,15
Os dados fornecidos pelo exercício foram:
-
Volume da solução 1 = 200 mL
-
Concentração em mol/L da solução 1 = 0,5 M ou mol/L
-
Volume da solução 2 = 300 mL
-
Concentração em mol/L da solução 1 = 0,2 M ou mol/L
-
Concentração em mol/L da solução final: ?
Os passos que devem ser seguidos são:
-
1º Passo: Calcular o volume final.
Para isso, basta somar os volumes das soluções misturadas:
VF = V1 + V2
VF = 200 + 300
VF = 500 mL
-
2º Passo: Determinar a concentração em mol/L da solução final.
Para isso, basta empregar na fórmula abaixo os valores fornecidos e o obtido no passo anterior:
M1.V1 + M2.V2 = MF.VF
0,5.200 + 0,2.300 = MF.500
100 + 60 = MF.500
MF = 160
500
MF = 0,32 mol/L
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias







.jpg)
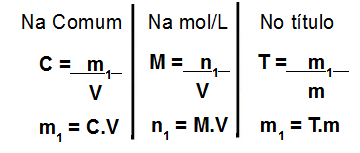
.jpg)











