Cálculos em mistura de soluções com solutos diferentes sem reação química
O foco deste texto é mostrar como são feitos os cálculos que envolvem uma mistura de soluções com solutos diferentes sem reação química. Esses cálculos envolvem basicamente:
Quando misturamos uma solução aquosa de cloreto de potássio (KCl) com uma solução aquosa de cloreto de cálcio (CaCl2), por exemplo, estamos realizando uma mistura de soluções de solutos diferentes sem reação química pelo fato de ambos os sais apresentarem o mesmo ânion: o cloreto.
→ Cálculo envolvendo o volume em uma mistura de soluções de solutos diferentes sem reação química
Como o solvente presente nas soluções é o mesmo, o volume da solução resultante será formado pela somatório dos volumes das soluções misturadas. Veja um exemplo:
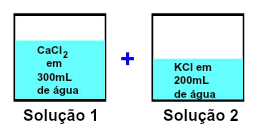
Ao misturar 300 mL de solução aquosa de CaCl2 com 200 mL de solução aquosa de KCl, o volume final terá que ser 500 mL, já que:
Vf = V1 + V2
Vf = 300 + 200
Vf = 500 mL
→ Cálculo envolvendo a massa em uma mistura de soluções de solutos diferentes sem reação química
Como os solutos presentes nas soluções que serão misturadas são diferentes, a massa de cada um dos solutos não sofrerá nenhuma alteração na solução resultante. Veja um exemplo:
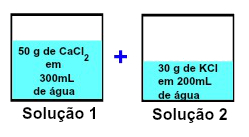
No exemplo, uma das soluções apresentava 50 g de CaCl2 em 300 mL de água, enquanto a outra possui 30 g de KCl dissolvidos em 200 mL de água. Ao misturar as soluções, continuou apresentando 30 g de KCl e 50 g de CaCl2.
Como os solutos são diferentes, ao misturar as soluções, a massa do soluto (m1) não sofrerá nenhuma alteração:
m1início = m1final
Concentração comum e molar de cada soluto
Aproveitando o exemplo anterior, podemos perceber que a quantidade de cada soluto não sofre alteração, mas essa mesma quantidade está em um novo volume. No exemplo, os 30 g de KCl estão agora em 500 mL de água, assim como os 50g de CaCl2 estão em 500 g de água.
Como as massas de soluto estão em uma maior quantidade de solvente, podemos concluir que cada soluto passa por uma diluição e, por isso, podemos utilizar as fórmulas destinadas a cálculos da concentração das soluções utilizadas na diluição:
C1.V1 = Cf.Vf
-
C1 = Concentração comum do soluto X
-
V1 = Volume da solução com o soluto X
-
Cf = Concentração do soluto X na solução resultante
-
Vf = Volume resultante da mistura de soluções
C2.V2 = Cf.Vf
-
C2 = Concentração comum do soluto Y
-
V2 = Volume da solução com o soluto Y
-
Cf = Concentração do soluto Y na solução resultante
M1.V1 = Mf.Vf
-
M1 = Concentração molar do soluto X
-
V1 = Volume da solução com o soluto X
-
Mf = Concentração molar do soluto X na solução resultante
M2.V2 = Mf.Vf
-
M2 = Concentração molar do soluto Y
-
V1 = Volume da solução com o soluto Y
-
Mf = Concentração molar do soluto Y na solução resultante
Exemplos de cálculos
(PUC-SP) Em um béquer foram misturados 200 mL de uma solução aquosa de cloreto de cálcio de concentração 0,5 mol.L–1 e 300 mL de uma solução 0,8 mol.L–1 de cloreto de sódio. A solução obtida apresenta concentração de ânion cloreto de, aproximadamente:
a) 0,34 mol.L–1
b) 0,65 mol.L–1
c) 0,68 mol.L–1
d) 0,88 mol.L–1
e) 1,3 mol.L–1
Resolução
Dados fornecidos pelo exercício:
Solução 1: formada pelo cloreto de cálcio (CaCl2)
-
M1= 0,5 mol.L–1
-
V1= 200 mL
Solução 2: formada pelo cloreto de sódio (NaCl)
-
M1= 0,8 mol.L–1
-
V1= 300 mL
Para determinar a concentração em mol/L de cloreto na solução resultante, devemos fazer o seguinte:
1o Passo: Calcular o volume da solução final somando o volume da solução 1 com o da solução 2:
Vf = V1 + V2
Vf = 200 + 300
Vf = 500 mL
2o Passo: Calcular a concentração do cloreto de cálcio na solução final pela seguinte fórmula:
M1.V1 = Mf.Vf
0,5.200 = Mf.500
100 = Mf.500
Mf = 100
500
Mf = 0,2 mol.L-1
3o Passo: Calcular a concentração do cloreto de sódio na solução final pela seguinte fórmula:
M2.V2 = Mf.Vf
0,8.300 = Mf.500
240 = Mf.500
Mf = 240
500
Mf = 0,48 mol.L-1
4o Passo: Determinar a concentração de íons cloro referente a cada sal multiplicando a concentração de cada sal na solução final pela quantidade de átomos de cloro na composição de cada sal.
-
Solução 1: multiplicaremos a concentração 0,2 mol.L-1 por dois porque, na composição do cloreto de cálcio, temos dois átomos de cloro:
[Cl-] = 0,2.2
[Cl-] = 0,4 mol.L-1
-
Solução 2: multiplicaremos a concentração 0,2 mol.L-1 por dois porque, na composição do cloreto de sódio, temos dois átomos de cloro:
[Cl-] = 0,48.1
[Cl-] = 0,48 mol.L-1
5o Passo: Determinar a concentração de íons cloro na solução final somando a quantidade de cloro referente à solução 1 e à solução 2:
[Cl-] = 0,4 + 0,48
[Cl-] = 0,88 mol.L-1