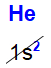Distribuição eletrônica dos elementos representativos
Quando realizamos a distribuição eletrônica dos elementos representativos, estamos distribuindo os elétrons dos elementos químicos que pertencem às famílias A da tabela periódica. As famílias dos elementos representativos são:
-
IA (grupo 1) ou família dos metais alcalinos
-
IIA (grupo 2) ou família dos metais alcalinoterrosos
-
IIIA (grupo 13) ou família do boro
-
IVA (grupo 14) ou família do carbono
-
VA (grupo 15) ou família do nitrogênio
Não pare agora... Tem mais depois da publicidade ;) -
VIA (grupo 16) ou família dos calcogênios
-
VIIA (grupo 17) ou família dos halogênios
-
VIIIA (grupo 18) ou família dos gases nobres
Obs.: O elemento hidrogênio não faz parte de nenhuma família da tabela periódica.
Um fato interessante é que, ao realizar a distribuição eletrônica dos elementos representativos, é possível observar que cada uma das famílias desses elementos apresenta um padrão, ou seja, um subnível mais energético específico. Confira a seguir alguns exemplos:
⇒ Família IA e Hidrogênio

Distribuições eletrônicas do hidrogênio, sódio e rubídio
Observando as distribuições eletrônicas do hidrogênio (Z=1), sódio (Z=11) e rubídio (Z=37), propostas acima, fica evidente que o subnível mais energético de todos os elementos da família IA e do hidrogênio é o s1, alterando apenas o nível (1, 2, 3... 7) em que esse subnível está.
⇒ Família IIA
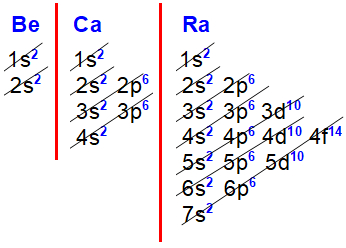
Distribuições eletrônicas do berílio, cálcio e rádio
Nas distribuições eletrônicas do berílio (Z=4), cálcio (Z=20) e rádio (Z=88), é perceptível que o subnível mais energético de todos os elementos da família IIA é o s2, alterando apenas o nível (2, 3... 7) em que esse subnível está.
⇒ Família IIIA
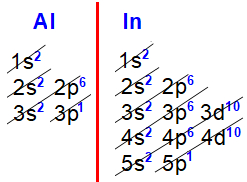
Distribuições eletrônicas do alumínio e Índio
Nas distribuições eletrônicas do alumínio (Z=13) e Índio (Z=49) fica nítido que o subnível mais energético de todos os elementos da família IIIA é o p1, sempre acompanhado do subnível s2, ambos no mesmo nível.
⇒ Família IVA
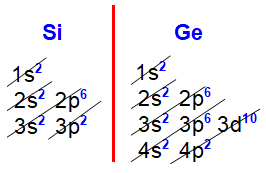
Distribuições eletrônicas do silício e germânio
Nas distribuições eletrônicas do silício (Z=14) e germânio (Z=32), constata-se que o subnível mais energético de todos os elementos da família IVA é o p2, sempre acompanhado do subnível s2, ambos no mesmo nível.
⇒ Família VA
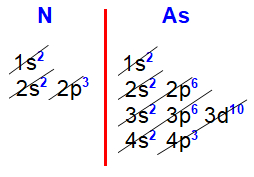
Distribuições eletrônicas do nitrogênio e arsênio
Nas distribuições eletrônicas do nitrogênio (Z=7) e arsênio (Z=33), fica evidente que o subnível mais energético de todos os elementos da família VA é o p3, sempre acompanhado do subnível s2, ambos no mesmo nível.
⇒ Família VIA
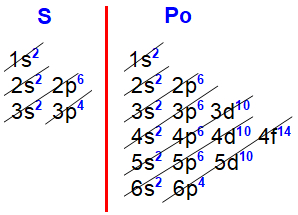
Distribuições eletrônicas do enxofre e polônio
Nas distribuições eletrônicas do enxofre (Z=16) e polônio (Z=84), fica claro que o subnível mais energético de todos os elementos da família VIA é o p4, sempre acompanhado do subnível s2, ambos no mesmo nível.
⇒ Família VIIA
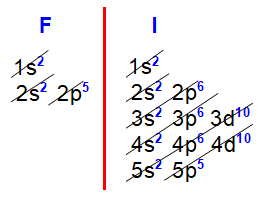
Distribuições eletrônicas do flúor e iodo
Nas distribuições eletrônicas do flúor (9) e iodo (Z=53), fica evidente que o subnível mais energético de todos os elementos da família VIIA é o p5, sempre acompanhado do subnível s2, ambos no mesmo nível.
⇒ Família VIIIA
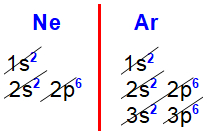
Distribuições eletrônicas do neônio e argônio
Nas distribuições eletrônicas do neônio (Z=10) e argônio (Z=18), propostas acima, fica perceptível que o subnível mais energético de todos os elementos da família VIIIA é o p6, sempre acompanhado do subnível s2, ambos no mesmo nível.
Porém, é importante ficar atento, porque o gás nobre hélio apresenta o subnível mais energético (s2) totalmente diferente de todos os elementos da família – fato esse que não o impede de ser um gás nobre.