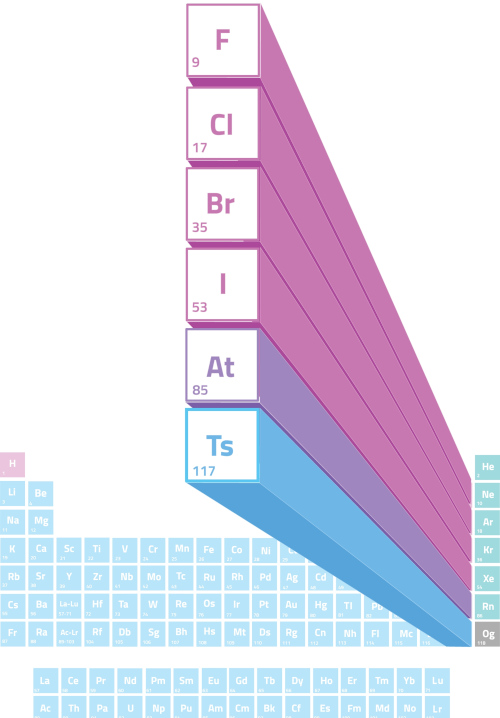
Halogênios
Os halogênios são os elementos químicos pertencentes ao grupo 17 da Tabela Periódica. Entre os mais famosos e utilizados, estão o flúor, cloro, bromo e iodo, uma vez que o astato é radioativo, com baixo tempo de meia-vida e muito raro, e o tenesso foi recentemente incluído na Tabela Periódica e não tem suas propriedades bem estudadas.
Os halogênios se destacam pela eletronegatividade, principalmente flúor e cloro, além de serem mais reativos que outros ametais, uma vez que necessitam de apenas um elétron para se estabilizar. Seus usos são diversos. O flúor é utilizado na odontologia, o cloro como bactericida, o bromo em retardantes de chamas e o iodo é essencial para as glândulas tireoidianas.
Veja também: Calcogênios — elementos químicos pertencentes ao grupo 16 da Tabela Periódica
Resumo sobre os halogênios
-
Os halogênios são os elementos que compõem o grupo 17 da Tabela Periódica.
-
Os halogênios mais usados no cotidiano são o flúor, cloro, bromo e iodo.
-
O astato é o elemento químico mais raro da crosta terrestre.
-
O tenesso é um halogênio sintético e recém-colocado na Tabela Periódica.
-
O flúor é o elemento mais eletronegativo da Tabela Periódica.
-
Os halogênios possuem ampla utilização, sendo utilizados como bactericidas, desinfetantes, fluidos de refrigeração, solventes orgânicos, na confecção de polímeros sintéticos etc.
O que são os halogênios?
Os halogênios são os elementos químicos localizados no grupo 17 da Tabela Periódica, a última coluna antes dos gases nobres. Pela Tabela Periódica atual, são halogênios:
Contudo, dentro do cotidiano da Química, apenas os quatro primeiros se destacam.
Nenhum halogênio é encontrado na forma elementar em nosso planeta, mas sim em compostos com outros átomos. São encontrados em minerais, como o caso da fluorita (CaF2) e criolita (Na3AlF6), ou em compostos salinos, como o cloreto de sódio (NaCl), presente em oceanos, lagos, como o Lago Salgado de Utah (Estados Unidos), e mares (Mar Morto e Mar Cáspio).

Características dos halogênios
-
Flúor
Como uma substância simples, o flúor é um gás diatômico, F2, de coloração amarelo-pálida e tóxico. No estado líquido, possui uma coloração amarela. É o elemento mais eletronegativo da Tabela Periódica e, por isso, é muito reativo.
-
Cloro
Já o cloro também é um gás diatômico, Cl2, em sua forma simples. Apresenta uma coloração amarelo-esverdeada e é tóxico, de cheiro forte e irritante aos olhos e ao sistema respiratório. É bastante abundante, na forma de cloreto (Cl-), em águas, sendo a principal espécie negativa encontrada, com cerca de 19 g/kg. Esse teor é maior do que toda a quantidade de cloro encontrada na crosta terrestre, cujo teor é estimado em 0,13 g/kg.
-
Bromo
O bromo também se apresenta na forma diatômica, Br2, contudo é um dos dois elementos da Tabela Periódica que se apresentam como líquido em condições ambientes (juntamente com o mercúrio). Sua coloração é castanha, é tóxico e, além disso, possui um cheiro desagradável. O nome bromo, inclusive, vem do grego bromos, que significa fétido.
-
Iodo
O iodo natural consiste apenas do isótopo 127, que é um sólido, em temperatura ambiente, de coloração cinza-violeta com um brilho que lembra o dos metais. Como os demais halogênios, apresenta-se como uma substância diatômica, I2, quando uma substância simples. É uma das poucas substâncias que, ao serem aquecidas, sofrem sublimação em pressão atmosférica.

-
Astato
A descoberta do astato não foi tão simples. Sua busca se iniciou em 1925 e só foi confirmada na década de 1940. Chegou a receber o nome de alabâmio (símbolo Ab), helvécio (símbolo Hv) e até mesmo dor (símbolo Do), sendo esse último para evocar um desejo de paz mundial após o fim da Segunda Guerra Mundial. Apenas em 1947, com sua confirmação, ele recebeu o nome que tem hoje, em referência à palavra grega astatos, a qual significa instável.
Além da propriedade que auxiliou em seu batismo, o astato é radioativo e também o elemento mais raro de nosso planeta, estimando-se uma quantidade total de apenas 28 g em toda crosta terrestre.
Especula-se que o astato seja um sólido negro e que sublime como o iodo em pressão atmosférica. Contudo, diferentemente dos demais halogênios, ainda é incerto que ele apresenta uma molécula diatômica (At2).
-
Tenesso
Já o tenesso, de símbolo Ts, é o halogênio mais recente na Tabela Periódica, sendo oficializado apenas em 2015. É um elemento sintético e pouco conhecido, uma vez que ainda não foram sintetizados compostos contendo esse elemento, afinal seus isótopos apresentam uma meia-vida muito curta, além de serem muito instáveis. Contudo, prevê-se que ele carregue algumas características dos halogênios mais antigos.
Veja também: Quais são os novos elementos da Tabela Periódica?
Propriedades dos halogênios
O flúor é o elemento mais eletronegativo da Tabela Periódica, assim como o cloro e o bromo possuem também uma alta eletronegatividade em comparação aos demais. O flúor, inclusive, não apresenta espécies com NOx positivo, até mesmo quando se liga ao oxigênio. O iodo, contudo, não possui uma eletronegatividade tão grande quanto os demais halogênios. Por isso, o iodo pode apresentar, sob certas condições, características catiônicas, como nos compostos inter-halogênicos IBr, ICl3 e IF3, nos quais apresenta NOx +1 e +3.
Além disso, o iodo também não é tão reativo quanto os demais halogênios de menor massa atômica, sendo inclusive o halogênio de menor poder oxidante. Todos os halogênios, inclusive o astato, conseguem formar compostos com o hidrogênio e, quando dissolvidos em água, formam hidrácidos, os quais são dispostos em ordem crescente de força a seguir: HF, HCl, HBr, HI e HAt.
Formam oxiácidos também, mas apenas cloro, bromo e iodo, em que os halogênios adquirem NOx +1, como o caso do ácido hipocloroso (HClO), +3, do ácido bromoso (HBrO2), +5, do ácido iódico (HIO3), +7, e do ácido perclórico (HClO4).
Os halogênios são de grande utilidade na Química Orgânica, pois podem formar os chamados compostos halogenados, que são produzidos mediante reações de adição ou substituição. O bromo, aliás, é muito utilizado para a preparação de compostos organometálicos, também chamados de compostos de Grignard.
Ainda na Química Orgânica, os halogênios são utilizados na produção de polímeros, como o teflon e o PVC.
O iodo é indispensável à dieta, sendo o elemento mais pesado encontrado em animais. Ele é utilizado pela tireoide para a formação de hormônios tireoidianos: o tri-iodotironina (T3) e a tiroxina (T4), responsáveis por estimular o metabolismo celular. Um dos distúrbios mais comuns associados à falta de iodo é o bócio, causado pela deficiência de iodo na alimentação ou má absorção deste pela glândula. O astato também tem capacidade de se acumular na tireoide, contudo uma quantidade significativa deste se distribui pelo corpo, com maior tendência a se concentrar no fígado.
Aplicações dos halogênios
Os halogênios possuem vasta utilização. O flúor, na forma de íons fluoreto e com concentração menor que 1 ppm, é excelente protetor dentário à ação das cáries e, por isso, está na composição de pastas de dentes. Algumas cidades do Brasil possuem água fluoretada, justamente para auxiliar no combate às cáries. Contudo, doses excessivas de flúor por ingestão de pasta de dente podem causar fluorose (principalmente em crianças), que causa manchas escuras na dentição.
O flúor ainda é utilizado na fabricação do teflon, um polímero muito utilizado na confecção de panelas e frigideiras antiaderentes, e, juntamente com o cloro, na produção dos freons, compostos organoclorados de apenas um carbono. O CCl2F2, Freon-12, é usado como líquido de refrigeração em aparelhos de ar-condicionado e em câmaras frigoríficas. Já o CCl3F pode ser usado como inseticida. Contudo, alguns freons estáveis e utilizados como propelentes são considerados os grandes vilões na destruição da camada de ozônio, responsável por nos proteger da radiação solar.

O cloro tem capacidade bactericida, sendo o DDT, diclorodifeniltricloroetano, um dos mais famosos no controle de pragas e outras doenças. O DDT faz parte dos compostos organoclorados, cada vez mais em desuso por conta de sua toxicidez e baixa degradabilidade. Apesar de banido, traços de DDT ainda são encontrados em praticamente todos os pontos de nosso planeta.
O cloreto de sódio, o sal de cozinha, é o tempero mais utilizado no mundo. Sua utilização é tão grande e difundida que a Organização Mundial de Saúde (OMS) recomenda a adição de iodo (na forma de iodato para não ser oxidado pelo oxigênio do ar) ao sal de cozinha, a fim de evitar surtos de bócio e garantir ingestão adequada desse elemento.
O sal tem tanta importância histórica que os soldados romanos eram pagos com sal, originando-se então a palavra salário, que, em latim, significa “pagamento de sal”. Antigamente, o sal valia tanto quanto o ouro, pois era uma das poucas maneiras de preservar a carne.
Ainda como bactericida, o cloro é adicionado ao tratamento de águas, tanto da rede distribuidora quanto de piscinas. Também é comum utilizar pastilhas de cloro para a desinfecção de saladas, legumes, verduras e frutas, algo que também pode ser feito com outro composto de cloro, a água sanitária (NaClO), bastante diluída em água. A água sanitária, inclusive, tem excelente ação de limpeza, podendo ser utilizada para higienização de superfícies e desinfecção de áreas hospitalares.
A água sanitária também tem poder alvejante, sendo empregada para o branqueamento de roupas e tecidos. Ademais, o nosso suco gástrico é feito de ácido clorídrico (HCL) majoritariamente.
De um ponto de vista mais trágico, o cloro foi uma das primeiras armas químicas, sendo utilizado o fosgênio (COCl2) durante a Primeira Guerra Mundial. O tetracloreto de carbono, CCl4, é um solvente orgânico apolar de ampla utilização mundial e também pode ser encontrado em extintores de incêndio. Derivados do CCl4 são empregados na fabricação do policloreto de vinila, PVC, e de borrachas sintéticas.
O bromo tem sua grande utilização como retardante de chamas, substâncias adicionadas em tecidos, plásticos automotivos e plásticos estruturais de televisões, rádios e eletrodomésticos. Esses compostos geram gases incombustíveis, reduzindo o suprimento de gás oxigênio e inibindo a propagação das chamas. Contudo, eles acabam por liberar gases tóxicos e que se acumulam em seres vivos, causando desordens fisiológicas. Por isso, retardantes alternativos sem a presença de bromo já estão sendo fabricados.
Além de sua importância na dieta, o iodo tem também propriedades antissépticas e expectorantes com soluções de iodeto de potássio. A iodopovidona é empregada em hospitais e clínicas como desinfetante da pele e no preparo pré-operatório.
O astato, apesar de ter sido considerado uma incógnita por muito tempo, tem seu isótopo 211At, um emissor alfa usado para diagnosticar doenças da tireoide e promissor para o tratamento de várias formas de câncer, em especial de tumores de pequena dimensão.
Veja também: Quais são as aplicações dos ácidos mais comuns?
Exercícios resolvidos sobre halogênios
Questão 1 – (UERJ 2016) O ânion do ácido produzido no estômago corresponde ao elemento químico pertencente ao grupo 17 e ao terceiro período da tabela de classificação periódica.
Esse ácido é denominado:
A) nítrico.
B) sulfúrico.
C) clorídrico.
D) fluorídrico.
Resolução
Alternativa C.
Como o elemento químico é pertencente ao grupo 17, podemos concluir que se trata de um halogênio. O halogênio do terceiro período é o cloro e, sendo assim, podemos concluir que se trata do ácido clorídrico, letra C.
O ácido clorídrico é de fato o ácido produzido no estômago, cujo nome comercial é ácido muriático.
Questão 2 (Enem 2017 — 2ª Aplicação) Os distúrbios por deficiência de iodo (DDI) são fenômenos naturais e permanentes amplamente distribuídos em várias regiões do mundo. Populações que vivem em áreas deficientes em iodo têm o risco de apresentar os distúrbios causados por essa deficiência, cujos impactos sobre os níveis de desenvolvimento humano, social e econômico são muito graves. No Brasil, vigora uma lei que obriga os produtores de sal de cozinha a incluírem em seu produto certa quantidade de iodeto de potássio.
Essa inclusão visa prevenir problemas em qual glândula humana?
A) Hipófise.
B) Tireoide.
C) Pâncreas.
D) Suprarenal.
E) Paratireoide.
Resolução
Alternativa B.
Como antes visto, o iodo é utilizado pela tireoide para a formação de hormônios tireoidianos T3 e T4, responsáveis por estimular o metabolismo celular. Um dos distúrbios mais comuns associado à falta de iodo é o bócio, causado pela deficiência de iodo na alimentação ou má absorção deste pela glândula.