Efeito indutivo
Efeito indutivo é o nome dado ao trânsito de elétrons que pertencem a ligações covalentes simples no interior de uma cadeia carbônica saturada (apresenta apenas ligações simples). Veja um exemplo desse tipo de cadeia:
![]()
Cadeia carbônica que apresenta apenas ligações simples em toda a sua extensão
O trânsito de elétrons ao longo da cadeia é provocado pela diferença de eletronegatividade (força de atração que um átomo exerce sobre os elétrons em uma ligação química com outro elemento) entre os átomos envolvidos. Veja a ordem decrescente da eletronegatividade entre os átomos:
A importância do efeito indutivo está na formação de regiões de maior e menor densidade eletrônica, ou seja, uma região negativa e uma positiva, respectivamente. As regiões formadas favorecem a ruptura de ligações e, consequentemente, reações químicas.
A formação da substância clorometano, por exemplo, só ocorre em uma reação de substituição (halogenação, especificamente) em virtude da ocorrência do efeito indutivo. Esse fenômeno promove a ruptura da ligação entre o carbono (representado por C) e o hidrogênio (representado por H). O carbono liga-se posteriormente a um átomo de cloro durante a halogenação.
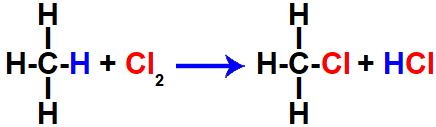
Equação química da halogenação do metano
Veja também: Reações de substituição
O efeito indutivo ocorre de duas maneiras: de forma negativa ou positiva. Isso depende do tipo de ligantes presentes na estrutura.
Efeito indutivo negativo (representado por I-)
O efeito indutivo é negativo quando os elétrons são atraídos para uma das extremidades da cadeia por um átomo ou grupo substituinte. Veja um exemplo:
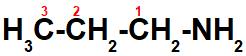
Fórmula estrutural da propilamina
O nitrogênio (N) é o átomo mais eletronegativo da cadeia e atrai para si os elétrons das ligações com os hidrogênios e com o carbono. Com isso, a extremidade da cadeia onde o nitrogênio está é negativa, enquanto o carbono 1 fica positivo. Veja a representação a seguir:
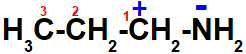
Polos formados na estrutura da propilamina
A consequência da formação desses polos na estrutura da propilamina é que uma ruptura pode ocorrer na ligação entre o carbono de número 1 e um de seus hidrogênios, favorecendo a chegada de um átomo nessa região durante uma reação química.
O efeito indutivo negativo sempre se prolonga ao longo da cadeia, mas é menos intenso nos carbonos de números 2 e 3.
Efeito indutivo positivo (representado por I+)
O efeito indutivo é positivo quando os elétrons são empurrados para o interior da cadeia por um átomo ou um grupo substituinte. Veja um exemplo:
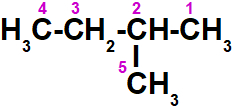
Fórmula estrutural do 2-dimetil-butano
Na estrutura do 2-dimetil-butano, existem apenas átomos de carbono e hidrogênio. Como o carbono é o mais eletronegativo, seus átomos atraem os elétrons das ligações com os hidrogênios.
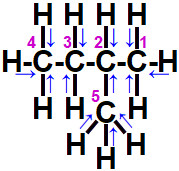
Representação do sentido da atração dos elétrons em cada carbono
Por causa da atração exercida sobre os elétrons das ligações com cada hidrogênio, os átomos de carbono adotam as seguintes cargas:
-
Carbono 1: carga -3
-
Carbono 2: carga -1
-
Carbono 3: carga -2
-
Carbono 4: carga -3
-
Carbono cinco: carga -3
Veja que a maior parte dos carbonos apresenta a mesma carga ou densidade eletrônica. As exceções são os carbonos 2 e 3. O carbono de número 2 está localizado na região de maior densidade eletrônica da cadeia. Os outros carbonos são regiões de menor densidade por não apresentarem outro ou outros átomos de carbono ligados a eles.
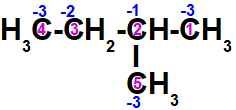
Representação da carga de cada um dos carbonos da cadeia carbônica
Por apresentarem maior densidade eletrônica, os carbonos de números 1 e 5 acabam empurrando (afastando) os elétrons da ligação com o carbono de número 2 em direção ao centro da cadeia. Esse fato caracteriza a ocorrência do efeito indutivo positivo.
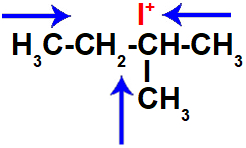
Representação do efeito indutivo no 2-metil-butano

