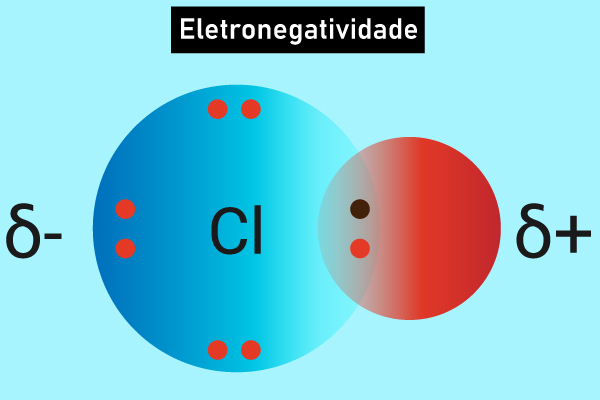
Eletronegatividade
Eletronegatividade é uma propriedade periódica que mede a capacidade que um átomo tem de atrair elétrons em uma ligação química. Nesse sentido, ela segue um padrão de aumento ou redução nos valores ao longo da tabela periódica, o que permite fazer previsões quanto aos tipos de ligações químicas que serão formadas nas reações. Além disso, esse conceito é fundamental para entender a polaridade das moléculas e a reatividade dos elementos, porquanto varia conforme o tamanho do átomo e sua carga nuclear efetiva. Dessa forma, quanto maior a eletronegatividade, maior a tendência de um elemento atrair elétrons para si.
Leia também: Ligações químicas — como ocorrem, tipos, regra do octeto
Resumo sobre eletronegatividade
- Eletronegatividade é a propriedade periódica que mede a capacidade de um átomo de atrair elétrons em uma ligação química.
- Pode ser determinada pela posição na tabela periódica e escalas numéricas, como a de Pauling.
- Quanto menor o raio atômico e maior a carga nuclear efetiva, maior a eletronegatividade.
- Aumenta da esquerda para a direita em um período e diminui de cima para baixo em um grupo.
- A diferença de eletronegatividade entre dois átomos determina o tipo de ligação: covalente ou iônica.
- Influencia a polaridade das moléculas e suas propriedades físicas, como solubilidade e ponto de ebulição.
- Determina a reatividade química dos elementos e afeta a distribuição de carga em ligações e interações intermoleculares.
- Eletronegatividade de Mulliken é a média aritmética entre energia de ionização e afinidade eletrônica.
- A diferença entre eletronegatividade e eletropositividade é que a primeira mede a tendência de atrair elétrons e a segunda mede a tendência de perder elétrons.
Videoaula sobre eletronegatividade
O que é eletronegatividade?
A eletronegatividade é a capacidade que um átomo possui de atrair elétrons para si em uma ligação química. Esse valor varia de acordo com o elemento químico e depende do tamanho do átomo e da carga nuclear efetiva.
Como identificar a eletronegatividade de um elemento?
A melhor forma de identificar a eletronegatividade de um elemento é consultando a tabela periódica, pois ela segue um padrão de variação previsível, no qual são utilizadas escalas numéricas como a de Linus Pauling, que atribui valores específicos a cada elemento. Além disso, ela pode ser estimada com base no tamanho do átomo e na carga nuclear efetiva: quanto menor o raio atômico e maior a atração do núcleo pelos elétrons, maior será a eletronegatividade.
Veja também: Qual é a estrutura de um átomo?
Eletronegatividade dos elementos da tabela periódica
A eletronegatividade dos elementos na tabela periódica pode ser visualizada a partir desta versão simplificada, cuja escala de cores é usada para sinalizar os elementos que apresentam baixa, média ou alta eletronegatividade:
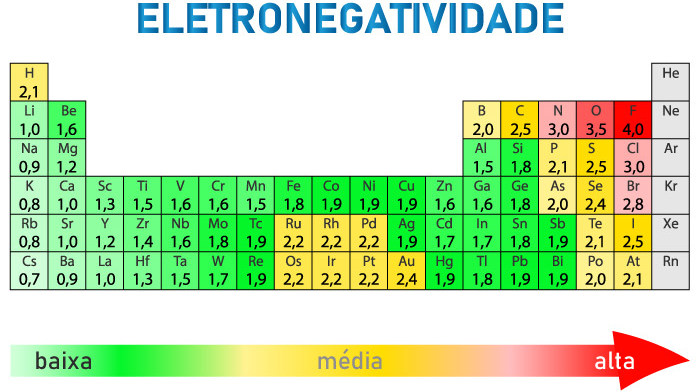
Vale ressaltar que a ela é geralmente medida pela escala de Pauling, cujos valores variam de aproximadamente 0,7 a 4,0. Outras escalas incluem a escala de Mulliken e a escala de Allred-Rochow, mas a de Pauling é a mais utilizada. Diante disso, veja a seguir uma tabela resumo contendo a eletronegatividade de alguns elementos:
|
Grupo/Período |
Elemento |
Eletronegatividade (Pauling) |
|
Grupo 17 |
Flúor (F) |
4,0 |
|
Grupo 16 |
Oxigênio (O) |
3,5 |
|
Grupo 15 |
Nitrogênio (N) |
3,0 |
|
Grupo 14 |
Carbono (C) |
2,5 |
|
Grupo 1 |
Sódio (Na) |
0,9 |
|
Grupo 2 |
Cálcio (Ca) |
1,0 |
Para fins didáticos, são usados vários mnemônicos para ajudar os estudantes a decorarem em ordem decrescente os elementos mais eletronegativos. Um deles é mostrado a seguir:
“Fui Ontem No Clube, Briguei I Saí Correndo Para o Hospital”
Perceba que o símbolo de cada elemento está sendo representado no início de cada palavra: Fluor; Oxigênio; Nitrogênio; Cloro; Bromo; Iodo; Sulphur (Enxofre); Carbono; Phosphorus (Fósforo); Hidrogênio.

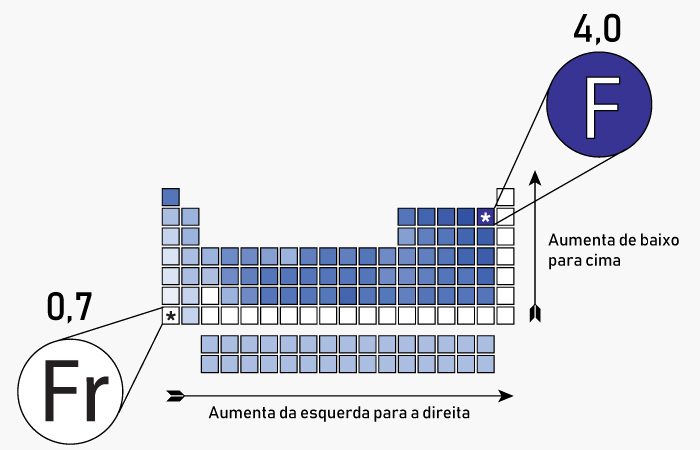
Variação de eletronegatividade na tabela periódica
- Aumenta à medida que se avança da esquerda para a direita em um período: Isso ocorre porque o número atômico aumenta, resultando em uma maior carga nuclear efetiva. Outro fato é que o núcleo exerce uma atração mais forte sobre os elétrons da camada de valência, aumentando a tendência de atrair elétrons.
- Diminui à medida que se desce em um grupo: Nesse caso, o número de camadas eletrônicas aumenta, fazendo com que os elétrons de valência fiquem mais distantes do núcleo e, portanto, menos atraídos por ele.
Por exemplo, o flúor está localizado na extremidade superior direita e, de fato, é considerado o elemento mais eletronegativo da tabela. Por outro lado, o frâncio, que se encontra na extremidade inferior esquerda, é o elemento menos eletronegativo.
Ademais, a partir da diferença de eletronegatividade apresentada pelos elementos, é possível obter outras informações importantes sobre as substâncias, a saber:
- Previsão do tipo de ligação química: a diferença de eletronegatividade entre dois átomos ajuda a prever se a ligação será iônica, covalente polar ou covalente apolar.
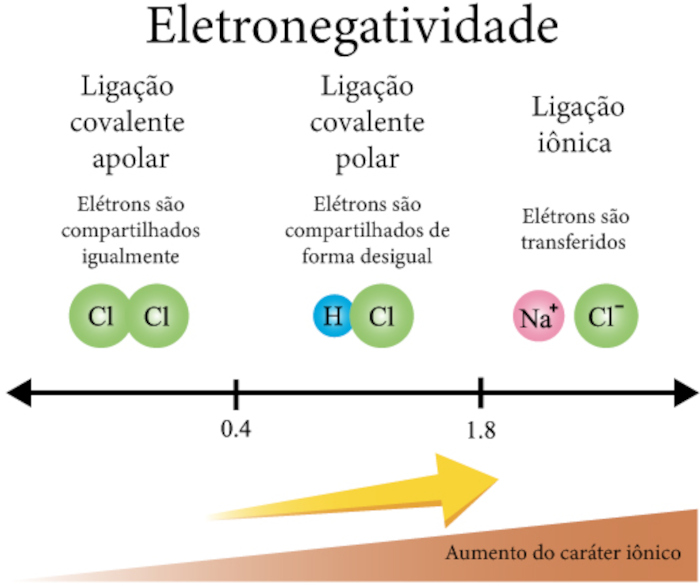
- Polaridade das moléculas: a eletronegatividade determina a distribuição de cargas em uma molécula, ou seja, define a polaridade delas, o que, por sua vez, influencia propriedades como solubilidade, ponto de ebulição e reatividade. Veja o exemplo da polaridade da água (H2O):
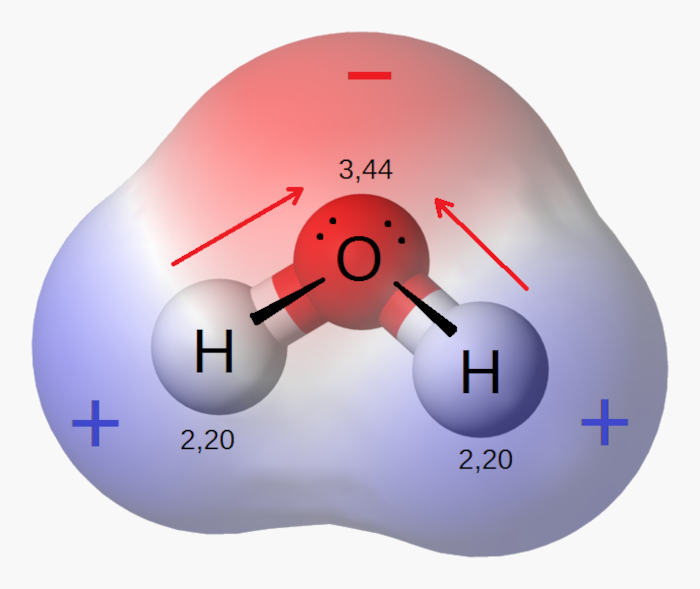
- Reatividade química: elementos com alta eletronegatividade tendem a ser mais reativos, especialmente em reações que envolvem a captura de elétrons.
Eletronegatividade segundo Robert Mulliken
Segundo Robert Mulliken, a eletronegatividade de um átomo pode ser determinada pela média aritmética entre sua energia de ionização e sua afinidade eletrônica. Mas antes de exemplos, primeiro entenda cada conceito:
- A energia de ionização (EI) é a energia necessária para remover um elétron de um átomo no estado gasoso.
- A afinidade eletrônica (AE) mede a tendência de um átomo no estado gasoso de ganhar um elétron.
Sendo assim, a fórmula para calcular a eletronegatividade de Mulliken (Xm) é:
\(Xm = \frac{E_I \ + \ A_E}{2}\)
O resultado é dado em elétrons-volt (eV) e, quanto maiores esses valores, maior será a eletronegatividade do elemento. Veja o exemplo do flúor, cujos dados de energia de ionização e afinidade eletrônica são:
EI = 17,42 eV
AE = 3,40 eV
\(Xm = \frac{17,42 \ + \ 3,40}{2} \quad \Rightarrow \quad Xm = \frac{20,82}{2} \quad \Rightarrow \quad Xm = \frac{20,82}{2} \quad \Rightarrow \quad Xm = \frac{20,82}{2} \quad \Rightarrow \quad Xm = 10,41 \, \ \text{eV}. \)
Agora, para fins de comparação, a eletronegatividade do sódio (Na):
EI = 5,14 eV
AE = 0,55 eV
\(Xm = \frac{5,14 \ + \ 0,55}{2} \quad \Rightarrow \quad Xm = \frac{5,69}{2} \quad \Rightarrow \quad Xm = 2,845 \, \ \text{eV}. \)
Repare que o flúor é bem mais eletronegativo que o sódio e que os resultados são proporcionais à energia de ionização e afinidade eletrônica de cada um. Por fim, a abordagem de Mulliken relaciona a eletronegatividade diretamente com propriedades energéticas do átomo, diferindo da escala de Pauling, que se baseia na diferença de energia das ligações químicas.
Diferenças entre eletronegatividade e eletropositividade
Em princípio podemos dizer que eletronegatividade e eletropositividade são propriedades opostas, isto é, enquanto a eletronegatividade mede a capacidade de um átomo de atrair elétrons em uma ligação química, a eletropositividade indica a tendência de um átomo de perder elétrons. Nesse contexto, elementos altamente eletronegativos, como o flúor, atraem fortemente os elétrons, enquanto metais alcalinos, altamente eletropositivos, cedem-nos com facilidade.
Por esse motivo, na tabela periódica, a eletronegatividade aumenta da esquerda para a direita e de baixo para cima, enquanto a eletropositividade segue o caminho inverso, conforme é ilustrado a seguir:
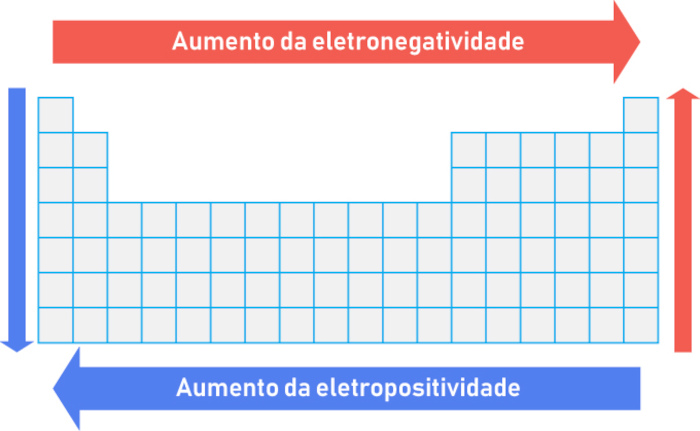
Outro fator importante é que, diferentemente da eletronegatividade, a eletropositividade não possui uma escala formal, mas pode ser inferida a partir da facilidade de ionização do elemento. Por exemplo, metais alcalinos (Grupo 1) são os mais eletropositivos. Por fim, enquanto a eletronegatividade é usada sobretudo para prever a polaridade das ligações e moléculas, a eletropositividade é usada para entender a reatividade de metais, especialmente em reações de oxidação.
Saiba mais: Propriedades periódicas e aperiódicas dos elementos químicos
Exercícios resolvidos sobre eletronegatividade
1. (UniREDENTOR) As propriedades periódicas correspondem àquelas que se repetem periodicamente na Tabela Periódica, ou seja, têm valores semelhantes em intervalos regulares, à medida que o número atômico aumenta. Um exemplo de propriedade periódica é a eletronegatividade, que é relacionada à força de atração exercida sobre elétrons de uma ligação. Dentre os elementos abaixo, assinale a alternativa com aquele que possui menor eletronegatividade:
a) flúor.
b) bromo.
c) hidrogênio.
d) lítio.
e) magnésio.
Gabarito: d.
Uma vez que na tabela periódica a eletronegatividade aumenta da esquerda para a direita e de baixo para cima, o caminho inverso indica o elemento com menor eletronegatividade. Sendo assim, à esquerda da tabela temos os metais, nos quais os alcalinos, grupo do qual o lítio faz parte, são os menos eletronegativos. Nesse caso, a resposta é: lítio.
2. (UCPL) Indique qual propriedade periódica é representada pela figura abaixo.
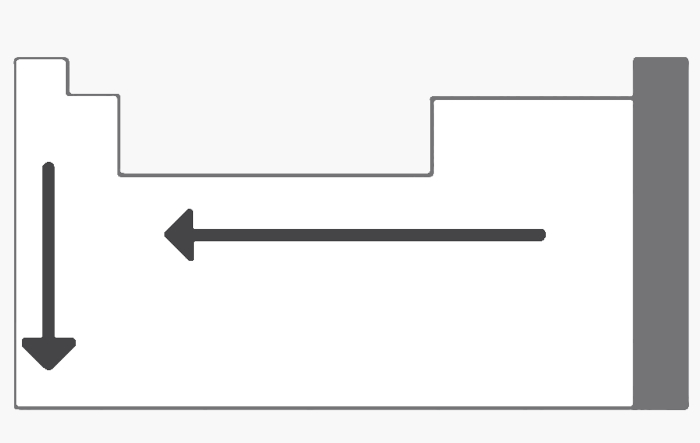
a) Afinidade eletrônica.
b) Eletronegatividade.
c) Eletropositividade.
d) Potencial de ionização.
e) Densidade.
Gabarito: c.
Afinidade eletrônica, eletronegatividade e potencial de ionização aumentam da esquerda para a direita e de baixo para cima. A densidade aumenta das extremidades para o centro. Já a eletropositividade segue o padrão mostrado na figura: da direita para a esquerda e de cima para baixo.
Créditos da imagem
Fontes
ALLRED, A. Modelos e eletronegatividade: uma proposta de sequência didática para o ensino de Química. Quimica Nova, v. 47, n. 2, p. 1–8, 2024.
ATKINS, P.; JONES, L.; LAVERMAN, L. As propriedades das ligações. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 95–102.
FELTRE, R. et al. Eletronegatividade/polaridade das Ligações e das moléculas. In: Química Geral. 7. ed. São Paulo: Moderna, 2008. p. 205–213.
L. BROWN, T. et al. Eletronegatividade. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 326–331.