Entalpia de Formação
A entalpia de formação, também denominada de calor de formação, entalpia padrão de formação e ΔH de formação, é a variação da entalpia, isto é, o calor que foi liberado ou absorvido na reação de formação de 1,0 mol de determinada substância a partir de seus elementos constituintes (substâncias simples), no estado padrão.
O estado padrão corresponde à forma alotrópica mais estável da substância simples, sob pressão de 1,0 atm, temperatura de 25ºC e concentração de 1,0 mol/L para as soluções. Os cientistas convencionaram dizer que o valor da entalpia padrão, simbolizado por H0, para as substâncias simples nesse estado padrão é igual a zero.
Até o momento não é possível medir experimentalmente o valor da entalpia (H) das substâncias, mas somente o valor da variação da entalpia (ΔH). Mas se tivermos a reação de formação de um composto a partir de substâncias simples no estado padrão e o valor da variação de entalpia da reação, conseguiremos calcular a entalpia de formação da substância formada.
Por exemplo, considere a seguinte reação de formação do ácido sulfúrico a partir de substâncias simples no estado padrão:
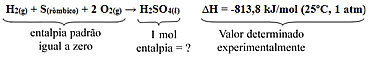
Pelo que foi convencionado, a entalpia das substâncias simples que formam o ácido sulfúrico na reação acima é igual a zero, então podemos determinar a entalpia de formação de 1 mol desse composto usando a seguinte fórmula:
?H = HProdutos – HReagentes
Substituindo os valores nessa fórmula, temos:
?H = HProdutos – HReagentes
-813,8 kJ/mol = HH2SO4 – (HH2 + HS+ H2 O2)
-813,8 kJ/mol = HH2SO4 – 0
HH2SO4 = - 813,8 kJ/mol
Temos que a entalpia padrão de formação é igual à entalpia do ácido sulfúrico (?Hf0 = H). Podemos ver isso por meio do gráfico da reação:
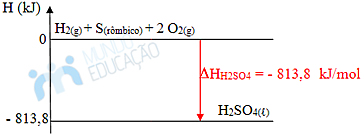
Isso pode ser feito para todas as substâncias. Mas é necessário prestar atenção se na reação de formação a proporção estequiométrica é dada por 1 mol da substância formada. Se não for o caso, será necessário apenas multiplicar a entalpia de formação do reagente pelo número de mols.
A seguir temos uma tabela com valores de entalpias de formação para várias substâncias descobertos a partir desse método:
.jpg)

