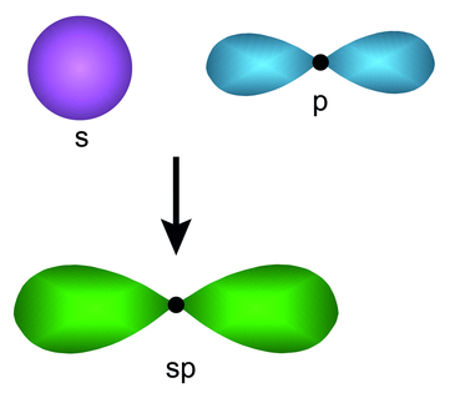
Hibridização do Berílio
O Berílio é um elemento químico metálico pertencente à família dos metais alcalinoterrosos, possui número atômico igual a 4 e apresenta a seguinte distribuição eletrônica:
1s2
2s2
O fato de o Berílio apresentar uma baixa energia de ionização favorece o seu caráter metálico (capacidade de perder elétrons), mas seus átomos possuem a capacidade de sofrer hibridização. A hibridização é um fenômeno que permite que os átomos de Berílio possam realizar ligações covalentes mesmo sendo metais.
Para realizar uma ligação covalente, um átomo deve apresentar obrigatoriamente um orbital ou orbitais atômicos incompletos. Analisando a distribuição eletrônica do Berílio, percebemos que os seus átomos apresentam apenas orbitais completos:
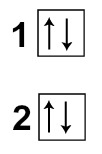
Representação dos orbitais completos 1s e 2s
Com o fenômeno da hibridização, os átomos do Berílio passam a apresentar orbitais atômicos incompletos. Entenda como isso ocorre:
Passo 1: Excitação dos elétrons do Berílio
Quando um átomo de Berílio recebe energia do meio externo, os elétrons passam a ficar mais excitados, principalmente os do nível mais externo (segundo nível), o que faz com que um dos elétrons presentes no orbital 2s passe a ocupar um dos orbitais do subnível p, que estava vazio, também presente no segundo nível.
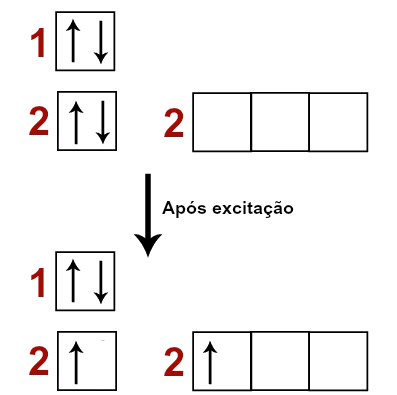
Representação do elétron saindo do orbital s para orbital p
Podemos representar a transição do elétron do orbital s para o orbital p utilizando algumas figuras, sendo elas a esfera, para o subnível s, e dupla-hélice, para o subnível p.
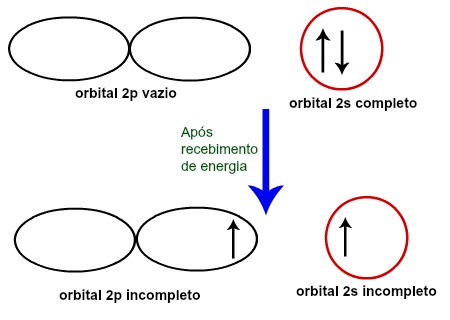
Elétron saindo do orbital s e partindo para o orbital p após a excitação
Passo 2: Hibridização dos orbitais incompletos
Após a excitação, o átomo do Berílio passa a apresentar dois orbitais atômicos incompletos. Esses dois orbitais atômicos incompletos unem-se e formam orbitais atômicos híbridos (ou hibridizados) do tipo sp.
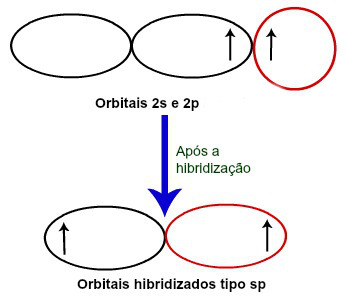
Formação dos orbitais hibridizados sp do Berílio
Conhecendo a hibridização que o Berílio pode sofrer, podemos determinar qual é tipo de cada ligação sigma entre os átomos de uma molécula, como o Hidreto de Berílio (BeH2). Abaixo temos a fórmula estrutural do Hidreto de Berílio:
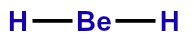
Fórmula estrutural do BeH2
Como o Berílio apresenta dois orbitais híbridos do tipo sp e cada um deles está ligado a um átomo de hidrogênio, que apresenta orbital atômico s incompleto, as duas ligações sigmas presentes no composto são do tipo s-sp.