Estrutura atômica

A estrutura atômica é a estrutura básica do átomo, hoje dividido em duas regiões básicas: o núcleo, eletricamente positivo e denso, e a eletrosfera, uma região periférica onde encontramos as partículas negativas. O núcleo é composto por prótons, de carga positiva, e nêutrons (eletricamente neutros), enquanto a eletrosfera é composta por elétrons, de carga negativa. Como os prótons e nêutrons, de massa semelhante, têm uma massa muito maior que a dos elétrons, é possível dizer que quase toda a massa do átomo se encontra no núcleo.
A estrutura atômica foi evoluindo ao longo do tempo, tendo sua primeira contribuição por meio dos trabalhos de J. J. Thomson, que descobriu os elétrons e a natureza elétrica da matéria, na virada do século XIX para XX. De lá para cá, com o desenvolvimento da mecânica quântica, a compreensão e descrição da estrutura do átomo avançou significativamente.
Leia também: Afinal, o que é o átomo?
Resumo sobre estrutura atômica
- A estrutura atômica é a estrutura básica de um átomo.
- Atualmente, entende-se que o átomo tem duas regiões principais: o núcleo, eletricamente positivo, além de denso, e a eletrosfera, que apresenta partículas de carga negativa.
- As principais partículas da estrutura atômica são os prótons, nêutrons e elétrons.
- Os prótons têm carga positiva e, com os nêutrons, eletricamente neutros, encontram-se no núcleo.
- Os elétrons têm carga negativa e ficam na eletrosfera.
- A massa dos prótons e nêutrons é muito maior que a massa dos elétrons.
O que é estrutura atômica?
A estrutura atômica é a estrutura básica de um átomo. Segundo os modelos atuais que descrevem o átomo, a estrutura atômica é composta por duas regiões principais: o núcleo, com carga positiva e denso, e a eletrosfera, região periférica do átomo que apresenta partículas de carga negativa.
Qual a estrutura do átomo?
Embora a compreensão do átomo seja, de certo modo, complexa, dada a necessidade de compreensão de aspectos quânticos, os cientistas, de modo geral, dividem o átomo em duas regiões:
- Núcleo: região densa, pois é muito pequena e concentra quase toda massa do átomo. É lá que estão os prótons, de carga positiva, e os nêutrons, partículas eletricamente neutras. Localiza-se no centro do átomo.
- Eletrosfera: região periférica do átomo onde se localizam os elétrons, de caráter negativo.
Um átomo é identificado pela sua carga nuclear, ou seja, pelo seu número de prótons. O número de prótons de um átomo é conhecido como número atômico e é representado pela letra Z.
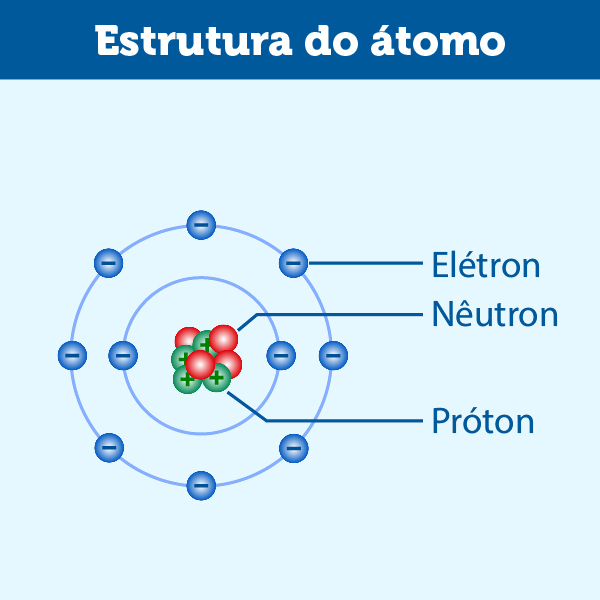
Partículas que constituem o átomo
Para uma compreensão básica do átomo, citamos três partículas constituintes:
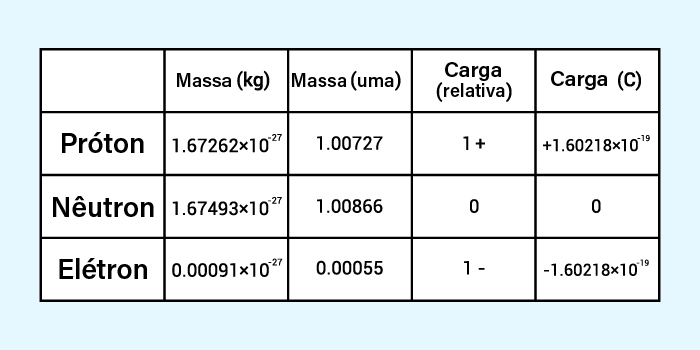
- Prótons: localizados no núcleo, têm carga elétrica positiva, cuja dimensão é na faixa de 1,6 x 10−19 C. A massa de um próton é igual a, aproximadamente, 1,672 x 10−27 kg, ou 1,007 u (unidades de massa atômica).
- Nêutrons: também estão no núcleo, porém apresentam eletroneutralidade. A massa de um nêutron é bem próxima da de um próton, sendo, aproximadamente, igual a 1,675 x 10−27 kg, ou 1,009 u.
- Elétrons: localizados na eletrosfera, apresentam carga elétrica negativa de mesma intensidade da dos prótons (−1,6 x 10−19 C). Como o átomo é eletricamente neutro, é possível afirmar que o número de elétrons de um átomo é igual ao seu número de prótons. Contudo, em relação a prótons e nêutrons, têm uma massa muito menor: aproximadamente 9,109 x 10−31 kg, ou 5,486 x 10−4 u. Isso quer dizer que são necessários cerca de 1836 elétrons para se ter a mesma massa de um único próton, ou cerca de 1838 elétrons para se ter a mesma massa de um único nêutron.
Como a massa dos elétrons é desprezível, a grandeza para determinar a massa do átomo, conhecida como número de massa (A), não leva em consideração essas partículas. Assim sendo, o número de massa é igual ao somatório de partículas presentes no núcleo (prótons e nêutrons): A = p + n ou A = Z + n.
Vale também dizer que os avanços na ciência e na compreensão da física das partículas permitiram que se fossem detectadas mais de 200 partículas subatômicas, embora boa parte delas seja altamente instável.
É bem verdade que essas partículas não são levadas em consideração em níveis mais básicos de ensino, mas saber de sua existência é interessante, pois, assim, é possível justificar alguns pontos importantes, como: de onde vem a carga positiva do próton ou por que o nêutron é eletricamente neutro. A resposta é: dentro dessas partículas, há partículas ainda menores, também dotadas de cargas, chamadas de quarks.
São os quarks constituintes dos prótons e nêutrons que, com suas cargas diferentes (existem quarks positivos e negativos), mantêm o núcleo coeso e ligado por meio de força de atração conhecida como “força forte”.
O elétron, entretanto, é uma partícula fundamental (ou elementar). Grosso modo, pode-se dizer que isso significa que o elétron não é constituído por partículas menores.
Estrutura atômica e a Tabela Periódica
A relação entre estrutura atômica e a Tabela Periódica se iniciou no começo do século XX, quando o jovem cientista inglês Henry Moseley trabalhou em uma hipótese trazida pelo advogado e físico amador Antonius van den Broek, o qual afirmou que propriedades químicas e ópticas de um elemento seriam determinadas pela sua carga nuclear, o número atômico (Z).
Utilizando técnicas de experimentação com raios X, Moseley conseguiu chegar a uma nova forma de identificar os elementos químicos. Nessa técnica, a utilização de raios X sobre os elementos químicos avaliados permitia a reflexão de espectros característicos de cada elemento (como se cada um tivesse a sua própria marca). O inglês então percebeu que a frequência dos raios X refletidos aumentava com o número atômico e não com a massa. Não só isso, o método permitiu a descoberta de novos elementos (quatro elementos foram descobertos graças aos trabalhos de Moseley).
Citando Moseley: “temos aqui uma prova de que existe no átomo uma quantidade fundamental, a qual aumenta por passos regulares quando se passa de um elemento ao seguinte. Essa quantidade só pode ser a carga elétrica do núcleo central positivo, da existência do qual já temos prova definitiva”.
Com isso, Moseley não só trouxe uma definição física para o número atômico, trazendo contribuições significativas para a estrutura atômica, como também forçou uma reorganização da Tabela Periódica. Agora as propriedades químicas eram funções periódicas da massa, e não mais de suas massas atômicas, como era a concepção original de Dmitri Mendeleev, o criador da tabela.
Para saber mais sobre a Tabela Periódica, clique aqui.
História da estrutura atômica
A estrutura atômica começou a ser elucidada com os trabalhos de Joseph John Thomson, já no fim do século XIX. Embora a concepção de que os átomos eram constituintes da matéria, sendo John Dalton o seu maior expoente, os cientistas apenas os tratavam como corpúsculos indivisíveis, ou seja, a menor fração possível da matéria.

O ponto de partida das contribuições de Thomson foram os experimentos de Michael Faraday, o qual percebeu que a passagem de uma corrente elétrica por uma solução eletrolítica podia promover reações químicas, dando início aos estudos referentes à eletrólise. Esse seria, talvez, um primeiro indício da natureza elétrica da matéria.
Posteriormente, um dos estudos mais interessantes de avaliação da influência de uma corrente elétrica sobre a matéria feito foi aquele realizado com gases rarefeitos inseridos em um aparato de vidro conhecido como ampola de Crookes. A passagem de uma corrente elétrica fazia surgir um feixe luminoso, o qual tinha origem no cátodo (eletrodo negativo) da ampola. Por conta disso, tais feixes ficaram conhecidos como “raios catódicos”.
A natureza negativa dos raios já era comprovada por sua origem no eletrodo negativo e pela influência de campos elétricos e magnéticos sobre eles. Posteriormente, com auxílio de materiais fluorescentes e fosforescentes inseridos na ampola, foi possível perceber que tais raios também dispunham de trajetória retilínea.
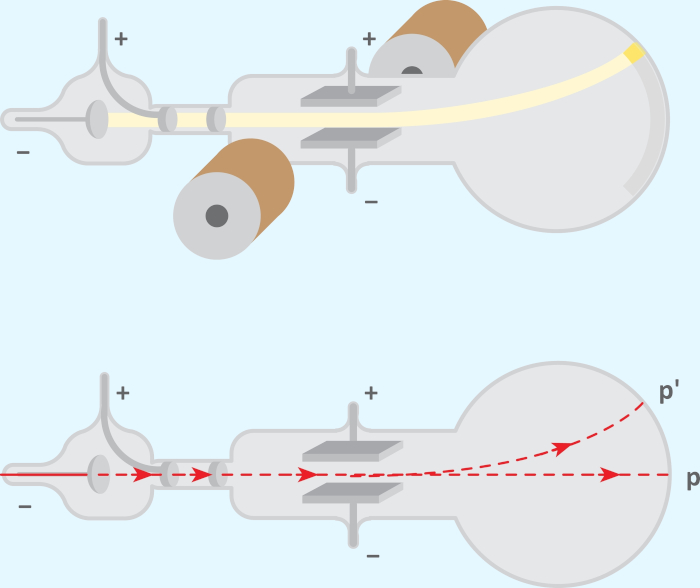
O brilhantismo de Thomson foi perceber que os raios catódicos tinham, na verdade, massa. Isso permitiu que ele criasse uma relação carga/massa, e, com base nisso, Thomson percebeu que, independentemente do gás utilizado, a relação se mantinha. Isso foi o necessário para que ele afirmasse que tais raios catódicos tinham origem no átomo, concluindo que as partículas que constituíam os raios catódicos (posteriormente chamados de elétrons) deveriam fazer parte da constituição de todos os átomos. Foi a primeira vez que o átomo teve uma estrutura proposta, pondo fim também na ideia de que o átomo seria um corpúsculo indivisível.
Ao publicar seus trabalhos, em 1904, na revista Philosophical Magazine, Thomson afirmou que o átomo seria composto de diversos corpúsculos negativos coplanares acoplados em uma esfera uniformemente positiva. Apesar de não haver menção a uma carga positiva, essa descrição feita pelo cientista foi importante para comprovar a eletroneutralidade do átomo.
Concomitante aos estudos e publicações de Thomson, surgia uma nova área de estudo intrigante: a radioatividade, em 1895, motivada pelas descobertas dos raios X (por Wilhelm Röntgen) e da radioatividade natural (por Henry Becquerel). Um dos cientistas mais importantes no campo da radioatividade foi o físico neozelandês Ernest Rutherford, que tinha grande interesse por partículas menores que o átomo. Rutherford, inclusive, foi responsável por caracterizar e nomear duas radiações ionizantes de grande importância, as partículas alfa e beta.

Inicialmente professor no Canadá, na Universidade McGill, Rutherford se mudou para a Universidade de Manchester, na Inglaterra, para ficar mais próximo dos centros de pesquisa da Europa. Lá ele continuava seus experimentos com partículas alfa. Por meio desses experimentos, ele já havia observado que feixes dessa radiação ionizante ficavam difusos ao passarem pelo ar ou por finas camadas de mica, sendo as partículas alfa desviadas num ângulo de dois graus. Esses resultados fizeram Rutherford pensar que “os átomos deveriam ser a origem de forças elétricas muito intensas”.
Em Manchester, ele recebeu um assistente, Hans Geiger, que ficou responsável por medir o número de partículas alfa que eram espalhadas por uma folha de ouro nesses pequenos ângulos de desvio. Posteriormente, juntou-se ao grupo o estudante Ernest Mardsen, em 1909. Já se sabia, à altura, que feixes de partículas beta (muito mais leves que as partículas alfa) poderiam ser espalhados em um bloco de metal, mas não se sabia se tal comportamento se replicava para as partículas alfa.
Assim, Rutherford instruiu que Mardsen fizesse o mesmo com um feixe de partículas alfa. Este percebeu que tais partículas não só eram espalhadas em um bloco de metal como também pelas folhas de ouro usadas por Geiger. Isso era, de fato, inesperado, fazendo Rutherford afirmar, posteriormente, que seria o mesmo que atirar um projétil de navio de 15 polegadas contra um lenço de papel e o projétil voltar para você.
Assim, Rutherford confessou a Geiger, alguns anos depois, a sua concepção da estrutura atômica, a qual foi, sem dúvida alguma, seu trabalho e contribuição mais conhecido: um núcleo com quase toda a massa com um único tipo de carga e que teria apenas milésimos da dimensão do átomo.
Foi apenas no ano de 1919 que Rutherford comprovou a existência de partículas positivas no núcleo atômico, as quais foram chamadas de prótons. Os elétrons, descobertos por Thomson, estariam em uma região em torno do núcleo, conhecida como eletrosfera, descrevendo uma trajetória circular, semelhante ao que os planetas fazem em torno do Sol.
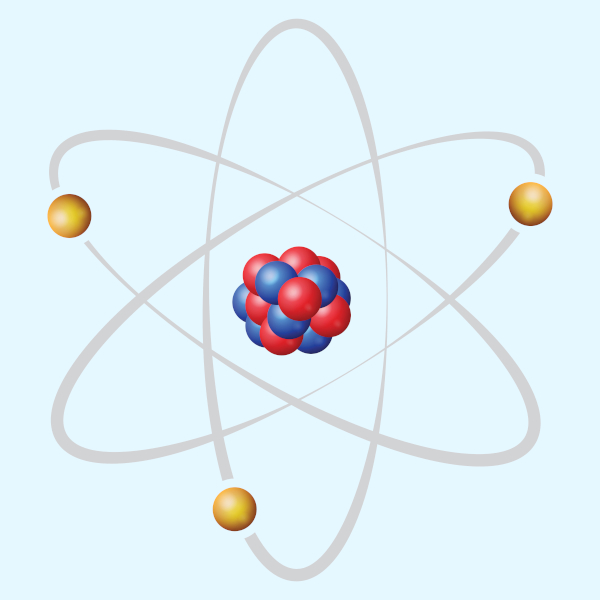
A proposta de Rutherford para o átomo já nasceu com prazo de validade. Isso porque o átomo, como proposto pelo físico neozelandês, era instável: não havia como elétrons, cargas elétricas, movimentarem-se sem perder energia. Isso ocasionaria na colisão dos elétrons com o núcleo pela teoria clássica do eletromagnetismo. Nesse contexto, alguns anos antes de Rutherford descrever os prótons, um aluno seu, o físico dinamarquês Niels Bohr, propôs uma correção ao modelo atômico vigente.
Bohr, mais novo, era mais adepto às teorias de mecânica quântica e Física moderna, as quais estavam sendo desenvolvidas no começo do século XX, graças aos trabalhos embrionários de Albert Einstein e Max Planck.
Com base em resultados obtidos pela espectroscopia, o dinamarquês propôs a quantização da energia dos elétrons, o que significou que, agora, eles não poderiam estar em qualquer região em torno do átomo (o que caracteriza uma energia contínua), mas apenas em níveis permitidos, camadas fixas, as quais foram chamadas de órbitas ou estados fundamentais. Assim sendo, enquanto presentes nessas camadas, os elétrons manteriam sua energia constante, podendo “orbitar” o núcleo se respeitassem seu estado fundamental.

Niels Bohr conseguiu resultados extraordinários, os quais iam de acordo com as linhas espectrais do átomo de hidrogênio. Bohr, ainda, chegou a descrever expressões matemáticas para o tamanho dos átomos, o chamado raio atômico. Mesmo assim, as descobertas no campo da mecânica quântica seguiam de forma fulminante, o que, em pouco tempo, tornou o átomo de Bohr obsoleto, mesmo com as adaptações propostas por Arnold Sommerfeld, em 1916.
A razão para tal é que o modelo de Bohr era excelente para descrever átomos monoeletrônicos, ou seja, com um único elétron, como era o caso do hidrogênio (e de suas espécies isoeletrônicas). A matemática utilizada por Bohr ainda não era capaz de prever os efeitos causados pela presença de mais elétrons na estrutura, o que, sabidamente, causa repulsões eletrônicas e altera os níveis fundamentais da eletrosfera.
Assim, o modelo atômico foi se atualizando ainda na primeira metade do século XX. Em 1932, James Chadwick comprovou a existência dos nêutrons, algo que já havia sido sugerido por Rutherford depois de avaliações de massas do núcleo atômico. A descoberta da dualidade onda-partícula, por Louis de Broglie, em 1925, e a elaboração do princípio da incerteza, por Werner Heisenberg, em 1927, marcaram a imersão da mecânica quântica na compreensão da matéria.
Hoje em dia, as órbitas dos elétrons, conhecidas como “orbitais atômicos”, são definidas como regiões de probabilidade de existência de elétrons, sendo que a determinação dessas regiões pode ser feita matematicamente pela resolução da equação proposta por Erwin Schrödinger. Assim, a interpretação moderna dos elétrons vem sendo, até então, a melhor forma de descrever a energia do átomo e suas partículas, bem como para justificar efeitos como ligações químicas e reações.
Para saber mais detalhes sobre os modelos atômicos, clique aqui.
Exercícios resolvidos sobre estrutura atômica
Questão 1
(Udesc) As investigações sobre a estrutura da matéria representam um importante marco na história da química, especialmente nos séculos XIX e XX, em que foi proposta a existência de várias partículas que podem ser encontradas em um átomo. Sobre essas partículas, analise as proposições.
I. Os prótons são partículas de carga positiva que estão localizadas no núcleo do átomo.
II. Os elétrons são partículas de carga negativa que estão localizadas na eletrosfera.
III. Os nêutrons são partículas sem carga elétrica e estão localizadas na eletrosfera.
IV. Os prótons possuem massa maior que a dos elétrons.
V. Os nêutrons estão localizados no núcleo do átomo e possuem massa equivalente à massa dos elétrons.
VI. Os prótons e os elétrons são partículas que, embora possuam cargas opostas, estão localizados no núcleo atômico.
Assinale a alternativa correta.
A) Somente as afirmativas I, II e III são verdadeiras.
B) Somente as afirmativas II, IV e V são verdadeiras.
C) Somente as afirmativas V e VI são verdadeiras.
D) Somente as afirmativas III e VI são verdadeiras.
E) Somente as afirmativas I, II e IV são verdadeiras.
Resolução:
Alternativa E
As afirmativas III, V e VI estão erradas, pois os nêutrons não estão na eletrosfera, mas sim no núcleo; os nêutrons não têm massa equivalente à massa dos elétrons, mas sim dos prótons; e elétrons não estão localizados no núcleo, mas sim na eletrosfera.
Questão 2
(Unilago) O átomo neutro de potássio (K) apresenta número de prótons e de massa iguais a 19 e 39, respectivamente. Ao perder um elétron, este átomo neutro se transforma em cátion, de carga elétrica +1.
Com base nessas informações e nos conhecimentos sobre estrutura de átomos, assinale a alternativa que apresenta, corretamente, o número de elétrons deste cátion formado.
A) 18
B) 19
C) 20
D) 21
E) 39
Resolução:
Alternativa A
Todo átomo é eletricamente neutro. Assim, o potássio, em sua forma atômica, apresenta 19 prótons e 19 elétrons. Ao perder um elétron, esse número cai para 18, ficando uma carga positiva a mais na estrutura.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
CAMPBELL, J. Rutherford, transmutation and the proton. CERN Courier. 8 mai. 2019. Disponível em: https://cerncourier.com/a/rutherford-transmutation-and-the-proton/.
CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
EPIOTIS, N. D.; HENZE, D. K. Periodic Table (Chemistry). Encyclopedia of Physical Science and Technology. p. 671-695. 3ª ed. Cambridge, EUA: Academic Press, 2003.
LOPES, C. V. M.; MARTINS, R. A. J. J. Thomson e o uso de analogias para explicar os modelos atômicos: o “pudim de passas” nos livros texto. Encontro Nacional de Pesquisa em Educação em Ciências. 8 nov. 2009.
NIST STANDARD REFERENCE DATABASE. CODATA Internationally recommended 2022 values of the Fundamental Physical Constants. Disponível em: https://physics.nist.gov/cuu/Constants/index.html.
SUTTON, C. Subatomic particle. Britannica. 31 jul. 2024. Disponível em: https://www.britannica.com/science/subatomic-particle. Acesso em 15 set. 2024.
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias





















