Atomística
A atomística é a área da Química responsável pelo estudo do átomo, como o histórico dos modelos representacionais do átomo, suas características, representações e notações e os tipos de semelhança entre os átomos.
Leia também: Evolução dos Modelos Atômicos
Resumo sobre atomística
-
A atomística estuda os conceitos relacionados ao átomo.
-
O átomo é a menor unidade que compõe a matéria; é composto por partículas subatômicas, que o conferem uma estrutura divisível.
-
Os átomos são caracterizados por: número atômico (Z); número de massa (A); elemento químico; representação na Tabela Periódica; e por seus ganhos e perdas de elétrons, quando são nomeados íons.
-
O modelo atômico atual estrutura o átomo em duas regiões: o núcleo, onde estão os prótons, e a eletrosfera, onde estão os elétrons.
-
A semelhança entre átomos tem a ver com a quantidade de suas partículas subatômicas (prótons, elétrons e nêutrons) ou, ainda, com seus números de massas.
-
Os tipos de semelhança entre átomos são: isótopos (têm o mesmo número atômico); isótonos (mesma quantidade de nêutrons no núcleo); isóbaros (mesma massa); isoeletrônicos (mesma quantidade de elétrons).
O que é átomo?
O átomo é a menor unidade que compõe a matéria, ou seja, é a unidade básica de todas as substâncias existentes. A palavra átomo é derivada do grego e significa “sem partes” ou “indivisível”, pois essa foi a primeira ideia que se teve a respeito da estrutura do átomo e da composição da matéria. Apesar do nome ser utilizado até hoje, sabe-se que o átomo é composto por partículas subatômicas, que o caracterizam como uma estrutura divisível.
Características do átomo
- Número atômico (Z)
O número atômico indica a quantidade de prótons que o átomo possui em seu núcleo, e é o dado utilizado para diferenciar os átomos entre si, uma vez que cada átomo possui uma quantidade de prótons diferente, ou seja, possui números atômicos diferentes. Caso tenha curiosidade sobre o tema, leia nosso texto: Número atômico e número de massa dos átomos.
- Número de massa (A)
O número de massa de um átomo pode ser calculado com base na soma da quantidade de prótons e nêutrons presentes no seu núcleo. A massa dos elétrons é desprezível em relação à massa dos prótons e nêutrons, por isso podemos afirmar que a massa do átomo está concentrada no núcleo. Podemos utilizar a seguinte fórmula para o cálculo do número de massa:
A = Z + n ou A = p + n
- Elemento químico
Elemento químico é o conjunto de átomos com o mesmo número atômico, e cada elemento químico é representado por um símbolo composto por uma ou duas letras, sendo que a primeira letra, ou no caso de ser apenas uma, deve sempre ser maiúscula. Por exemplo: Na — símbolo do elemento sódio; Mg — símbolo do elemento magnésio; C — símbolo do elemento carbono etc. Caso queira saber mais sobre o assunto, leia nosso texto: Elementos químicos.
- Representação do átomo
Na Tabela Periódica dos elementos químicos, estão representados todos os átomos já encontrados, naturais ou sintéticos, em ordem crescente de número atômico, que vai do 1 até o 118. Como regra, deve conter na representação o símbolo do elemento, o número atômico e o número de massa. Veja um exemplo:

Algumas Tabelas Periódicas trazem informações complementares dos elementos químicos, como: estado físico, número de oxidação, distribuição eletrônica, densidade etc.
Veja também: Distribuição eletrônica e a Tabela Periódica
- Íons
Os átomos nos seus estados fundamentais, como são encontrados na Tabela Periódica, são neutros, isto é, possuem a mesma quantidade de prótons e elétrons em sua estrutura.
No entanto, para a maioria dos átomos, essa igualdade não é possível, uma vez que eles precisam perder ou ganhar elétrons, a fim de tornarem-se estáveis em um estado de energia mais baixo. Quando isso ocorre, dizemos que os átomos tornaram-se íons.
Quando o átomo perde elétrons, ele passa a ter excesso de prótons, ao que damos o nome de cátion. Quando o átomo ganha elétrons, ele se torna negativamente carregado, ou seja, tem mais elétrons do que prótons. Esse íon negativo, com excesso de elétrons, é chamado de ânion.
Esses íons são representados pelas cargas colocadas junto aos seus respectivos símbolos. Vejamos os exemplos:
- Ca 2+ — quando o átomo de cálcio perde dois elétrons, ele se torna um cátion bivalente, representado pela carga 2+.
- Br - — quando o átomo de bromo ganha um elétron, ele se torna um ânion monovalente, representado pela carga –.
Acesse também: Descarga de cátions e ânions
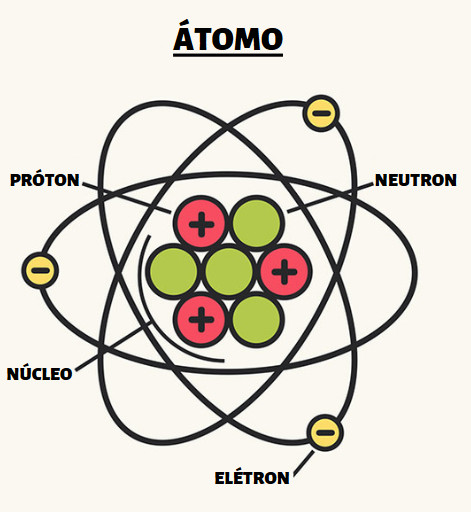
Estrutura do átomo
O modelo atômico atual divide o átomo em duas regiões: o núcleo e a eletrosfera. No núcleo está concentrada a maior parte da massa do átomo e é onde encontramos os prótons, partículas positivas, e os nêutrons, partículas sem carga. Na eletrosfera, encontramos os elétrons orbitando em camadas energéticas ao redor do núcleo.
Semelhança de átomos
Ao analisar dois átomos diferentes, podemos encontrar semelhanças entre a quantidade de suas partículas subatômicas (prótons, elétrons e nêutrons) ou ainda entre seus números de massas. Segue análise de cada um dos tipos de semelhanças atômicas:
- Isótopos: são átomos que possuem a mesma quantidade de prótons, ou seja, o mesmo número atômico (Z), mas diferem quanto ao número de massa. Por exemplo: C-12, C-13 e C-14 são isótopos do carbono. Todos eles possuem número atômico igual a 6, porém suas massas são 12, 13 e 14, respectivamente.
- Isótonos: são átomos que possuem a mesma quantidade de nêutrons no núcleo e diferem quanto ao número de prótons e massa. Exemplo: 26 Mg 12 e 28 Si 14. Se calcularmos a quantidade de nêutrons de cada átomo usando a fórmula A = Z + n, encontraremos 14 desses para ambos.
- Isóbaros: são átomos que, apesar de possuírem número atômico e quantidade de nêutrons diferentes, possuem a mesma massa. Exemplo: 40 Ca 20 e 40 Ar 18.
- Isoeletrônicos: são espécies químicas (átomos ou íons) que possuem a mesma quantidade de elétrons. Exemplo: 26 Mg2+12 e 20 Ne 10. Ambos possuem 10 elétrons em sua eletrosfera.
Exercícios resolvidos
Questão 01 (Udesc-SC) Após a realização de uma série de experimentos, foi detectado um íon Q2–, que possui carga 2–, possuindo assim número de elétrons igual a um gás nobre. O gás nobre em questão possui número atômico 18 e número de massa 40.
Assinale a alternativa que contém, sequencialmente, o elemento Q e seu número atômico.
a) O elemento Q é o argônio e possui número atômico 18.
b) O elemento Q é o oxigênio e possui número atômico 8.
c) O elemento Q é o cloro e possui número atômico 17.
d) O elemento Q é o enxofre e possui número atômico 16.
e) O elemento Q é o enxofre e possui número atômico 18.
Veja também: Distribuição eletrônica e a Tabela Periódica
Resolução
Letra d. No enunciado é falado que o elemento Q contém o mesmo número de elétrons de um gás nobre que possui 18 prótons e, por estar no estado fundamental, também possui 18 elétrons. Portanto, o elemento Q também possui 18 elétrons. Também é falado que o elemento possui carga 2–, ou seja, possui 2 elétrons a mais do que a quantidade de prótons. Portanto o elemento Q possui 16 prótons, que é o número atômico do elemento enxofre.
Questão 02 (Famerp-SP) O íon ![]() e o átomo
e o átomo ![]() apresentam o mesmo número
apresentam o mesmo número
a) de massa e de elétrons.
b) atômico e de elétrons.
c) de massa e de nêutrons.
d) atômico e de massa.
e) atômico e de nêutrons.
Resolução
Letra a. Observando a representação do íon e dos átomos, percebemos, primeiramente, que ambos possuem número de massa igual a 40. O número de prótons do Ca2+ é 20 e do Ar é 18, portanto o número atômico é diferente.
Calculando o número de nêutrons, temos 20 e 22, respectivamente. Entretanto, ao calcular a quantidade de elétrons do Ca2+, encontramos 18 elétrons (a carga 2+ indica que o íon possui 2 prótons a mais do que a quantidade de elétrons), igual ao número de elétrons do Ar que se encontra em seu estado fundamental. Desse modo, o número de prótons é igual ao número de elétrons.
Questão 03 (Uerj) O desastre de Chernobyl ainda custa caro para a Ucrânia. A radiação na região pode demorar mais de 24.000 anos para chegar a níveis seguros.
Adaptado de Revista Superinteressante, 12/08/2016.
Após 30 anos do acidente em Chernobyl, o principal contaminante radioativo presente na região é o césio-137, que se decompõe formando o bário-137.
Esses átomos, ao serem comparados entre si, são denominados:
a) isótopos
b) isótonos
c) isóbaros
d) isoeletrônicos
Resolução
Letra c. Pela nomenclatura usada no enunciado, percebemos que a massa informada dos dois elementos é a mesma, 137. Átomos que possuem a mesma massa são chamados de isóbaros.