Reações de dupla troca entre sais

Uma reação de dupla troca é aquela em que duas substâncias compostas originam outras duas substâncias compostas por meio da troca de cátions e ânions, ou seja, o cátion (X) da substância 1 une-se ao ânion (W) da substância 2, e o ânion (Y) da substância 1 une-se ao cátion (Z) da substância 2. Veja um exemplo abaixo:
XY + ZW → XW + ZW
Se tivermos uma reação de dupla troca entre sais, obrigatoriamente, os reagentes dessa reação serão dois sais e os produtos também serão dois sais, como no exemplo representado abaixo:
NaBr + KI → NaI + KBr
OBS.: Denomina-se sal toda substância que apresenta um cátion diferente do hidrônio (H3O+) e um ânion diferente da hidroxila (OH-).
Visualmente falando, dizemos que uma reação de dupla troca entre sais ocorreu se um ou os dois sais formados no processo forem praticamente insolúveis em água. Isso acontece porque, quando esse tipo de sal é formado, é possível visualizar um material sólido no recipiente em que a reação aconteceu.
É importante conhecer a tabela de solubilidade de sais para que seja possível prever se a reação de dupla troca entre sais ocorrerá visualmente falando ou não. Veja a tabela de solubilidade dos sais:
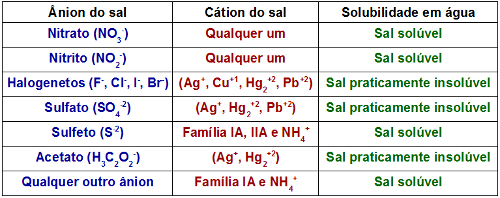
Os sais podem ser solúveis ou praticamente insolúveis
Assim, tendo conhecimento sobre a tabela de solubilidade dos sais e quais devem ser os produtos, podemos prever se cada uma das reações representadas pelas equações abaixo acontece ou não:
Exemplo 1: Dupla troca entre Carbonato de cálcio (CaCO3) e Fosfato de Magnésio [Mg3(PO4)2]
2 CaCO3 + Mg3(PO4)2 → Ca3(PO4)2 + 2 MgCO3
Quando o Carbonato de cálcio (CaCO3) e o Fosfato de Magnésio [Mg3(PO4)2] reagem, originam os sais carbonato de magnésio (MgCO3) e fosfato de cálcio [Ca3(PO4)2]. Tanto o fosfato quanto o carbonato formados não apresentam elementos da família IA e nem são o amônio, por isso, essa reação forma dois sais praticamente insolúveis na água. Visualmente, é uma reação que acontece.
Exemplo 2: Dupla troca entre Iodeto de chumbo II (PbI2) e Permanganato de lítio (LiMnO4)
PbI2 + 2 LiMnO4 → Pb(MnO4)2 + 2 LiI
Quando o iodeto de chumbo II (PbI2) e o permanganato de lítio (LiMnO4) reagem, originam os sais iodeto de lítio (LiI) e o permanganato de chumbo II [Pb(MnO4)2]. Como o iodeto de lítio apresenta elemento da família IA, ele é um sal solúvel. Já o permanganato, que se encaixa nos outros ânions da tabela, não apresenta nem elemento da Família IA e nem é o amônio, por isso, é um sal praticamente insolúvel na água. Em razão do Permanganato de chumbo II formado, a reação, visualmente, acontece.
Exemplo 3: Sulfato de cobre II (CuSO4) e Dicromato de potássio (K2Cr2O7)
CuSO4 + K2Cr2O7→ CuCr2O7 + K2SO4
Quando o Sulfato de cobre II (CuSO4) e o Dicromato de potássio (K2Cr2O7) reagem, originam os sais Dicromato de cobre II (CuCr2O7) e Sulfato de potássio (K2SO4). Como o sulfato de potássio apresenta elemento da família IA, ele é um sal solúvel. Já o dicromato, que se encaixa nos outros ânions da tabela, não apresenta nem elemento da IA e nem é o amônio, por isso, é um sal praticamente insolúvel na água. Em razão do dicromato de cobre II formado, a reação, visualmente, acontece.
Exemplo 4: Borato de rubídio (Rb3BO3) e Isocianato de crômio III [Cr(NOC)3]
2 RbBO3 + Cr(NOC)3→ 2 RbNOC + CrBO3
Quando o borato de rubídio (Rb3BO3) e o isocianato de crômio III [Cr(NOC)3] reagem, originam os sais Borato de crômio III (CrBO3) e Isocianato de rubídio (RbNOC). Tanto o borato quanto o isocianato enquadram-se nos outros ânions da tabela fornecida acima e não apresentam elementos da família IA e nem são o amônio, por isso, essa é uma reação que forma dois sais praticamente insolúveis na água e, visualmente, acontece.
Exemplo 5: Cloreto de Potássio (KCl) e Nitrato de ferro II [Fe(NO3)2]
2 KCl + Fe(NO3)2 → 2 KNO3 + FeCl2
Quando o Cloreto de Potássio (KCl) e o Nitrato de ferro II [Fe(NO3)2] reagem, originam os sais Nitrato de potássio (KNO3) e Cloreto de ferro II (FeCl2). Analisando a tabela, observamos que todo nitrato é solúvel, logo, o nitrato de potássio formado também é solúvel, assim como o cloreto de ferro II, já que o cloreto só forma sal praticamente insolúvel com os cátions prata, cobre I, mercúrio I e chumbo II. Dessa forma, trata-se de uma reação que visualmente não acontece.
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















