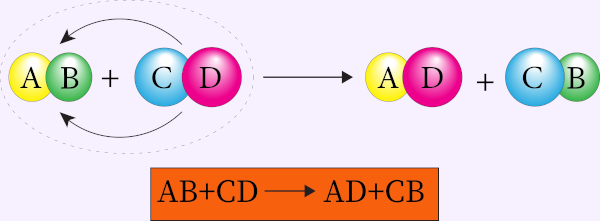
Reação de dupla troca
As reações de dupla troca (também conhecidas como reações de permutação) configuram um mecanismo específico de reações inorgânicas, em que duas substâncias compostas reagem para a formação de duas novas substâncias compostas. Essas novas substâncias compostas surgem por meio da permutação das espécies positivas e negativas das substâncias compostas de origem.
As reações de dupla troca precisam de condições específicas para ocorrer que envolvem a formação de produtos insolúveis, voláteis e/ou de menor grau de ionização. Além das reações de dupla troca, também existem, na Química inorgânica, as reações de adição (ou síntese), decomposição (ou análise) e simples troca (ou deslocamento).
Leia também: Como ocorrem as reações químicas?
Resumo sobre reação de dupla troca
- Uma reação de dupla troca (ou permutação) é um tipo de reação inorgânica em que duas substâncias compostas reagem entre si, formando duas novas substâncias compostas.
- Em uma reação de dupla troca, a espécie mais positiva da primeira substância composta se liga com a espécie mais negativa da outra substância composta, enquanto a substância mais negativa da primeira substância composta se liga com a espécie mais positiva da outra substância composta.
- Uma reação de dupla troca necessita de condições para ocorrência: formação de produto insolúvel, formação de produto mais volátil, ou formação de produto de menor grau de ionização.
- Além das reações de dupla troca, existem as reações de adição, decomposição e simples troca.
Videoaula sobre reação de dupla troca
O que é reação de dupla troca?
A reação de dupla troca, também chamada de permutação, é uma modalidade de reação inorgânica em que duas substâncias compostas reagem entre si, formando duas novas substâncias compostas. De modo geral, é possível representar a reação de dupla troca da seguinte forma:
AB + CD → AD + BD
Como ocorre a reação de dupla troca?
A substância composta pode ser entendida como sendo a junção de uma espécie eletropositiva e uma espécie eletronegativa, se for covalente, ou uma espécie positiva (um cátion) e uma espécie negativa (um ânion), se for iônica. Para ocorrer a reação de dupla troca, a parte mais negativa de uma substância composta reagente deve se ligar à parte mais positiva da outra substância composta reagente.
Consequentemente, a parte mais positiva dessa primeira substância composta reagente se liga com a parte mais negativa da outra substância composta reagente. Por isso que a reação é chamada de dupla troca ou permutação, pois as partes de caráter antagônico permutam entre si.
Vejamos o exemplo da reação a seguir.
HCl + NaOH→ NaCl + H2O
Na primeira substância, HCl, o hidrogênio é a parte mais positiva (menor eletronegatividade), enquanto o cloro é a parte mais negativa. Na segunda substância, NaOH, o sódio se encontra na forma do cátion Na+, enquanto o hidróxido é um ânion, OH−. Assim sendo, o hidrogênio se liga ao íon hidróxido e forma a água, H2O, enquanto o sódio se liga ao cloro para formação do cloreto de sódio (NaCl).
Veja também: O que são substâncias simples e substâncias compostas?
Como identificar reação de dupla troca?
As reações de dupla troca apresentam características específicas que marcam a sua conclusão, as quais podem ser:
- a formação de um precipitado (corpo de fundo);
- o desprendimento de um produto gasoso;
- a formação de um produto de menor grau de ionização.
Entende-se, aliás, que essas reações só ocorrerão se, pelo menos, um dos critérios for observado. Vamos descrever melhor essas condições com os exemplos a seguir.
- Um dos produtos deve ser menos solúvel que os reagentes, precipitando ao fim da reação:
NaI (aq) + AgNO3 (aq) → NaNO3 (aq) + AgI (s)
No caso, o sal AgI é muito pouco solúvel e a sua formação como corpo de fundo marca a conclusão da reação.
Já a reação seguinte não é possível:
NaCl (aq) + KNO3 (aq) → NaNO3 (aq) + KCl (aq)
Isso porque ambos os produtos formados são muito solúveis em água, assim como os reagentes.
- Um dos produtos deve ser mais volátil que os reagentes:
NaCN (aq) + HBr (aq) → HCN (g) + NaBr (aq)
Na reação apresentada, percebe-se a formação do gás cianídrico, HCN, o qual é um composto volátil e, por isso, se desprende da solução em forma gasosa.
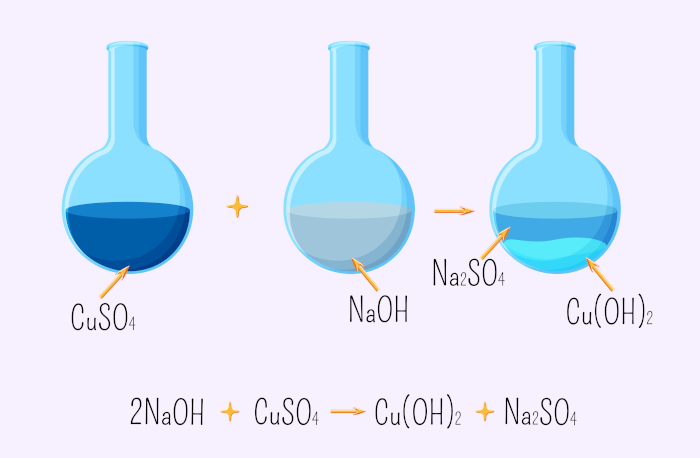
- Um dos produtos deve ter menor grau de ionização que um dos reagentes:
2 NaOH (aq) + CuSO4 (aq) → Na2SO4 (aq) + Cu(OH)2 (s)
O Cu(OH)2 apresenta menor ionização que o NaOH, pois é uma base mais fraca em comparação. Além disso, também é um composto pouco solúvel, o que ainda concorda com a regra de número I para ocorrência de reações de dupla troca.
Tipos de reações químicas
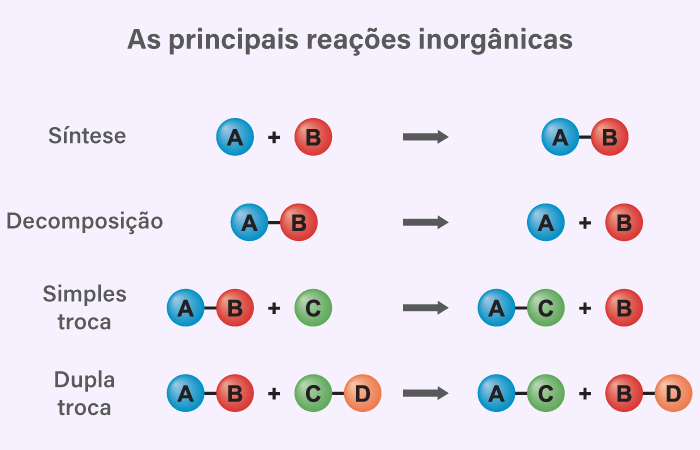
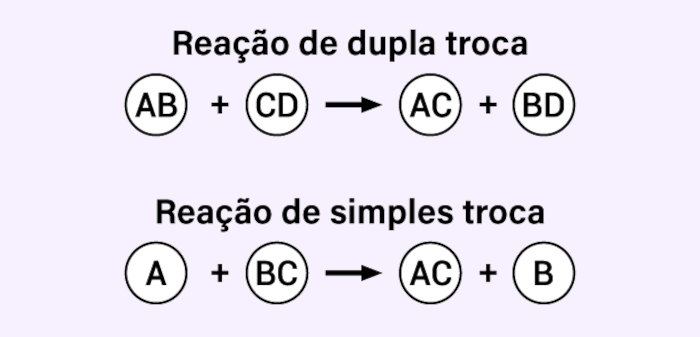
As reações de dupla troca configuram apenas um dos mecanismos de reações inorgânicas possíveis. Além delas, existem outros três:
- Reações de adição (ou síntese): quando dois ou mais reagentes se combinam em um único produto.
SO3 + CaO → CaSO4
- Reações de decomposição (ou análise): seria o sentido inverso da reação de adição, ou seja, quando um único reagente se desprende em dois ou mais produtos.
2 KMnO4 → K2O + 2 MnO2 + 3/2 O2
- Reações de simples troca (ou deslocamento): nessa reação, uma substância simples reage com uma substância composta, deslocando o elemento de caráter semelhante. Dessa forma, um elemento eletropositivo só deslocará um elemento eletropositivo, enquanto um elemento eletronegativo só deslocará um elemento eletronegativo.
2 K + 2 H2O → 2 KOH + H2
Além das reações inorgânicas, existem as reações orgânicas, as quais envolvem compostos orgânicos (que têm cadeias carbônicas).
Saiba mais: Quais são as principais funções inorgânicas?
Diferenças entre reação de dupla troca e reação de simples troca
As reações de simples troca e dupla troca têm estruturas distintas. A principal diferença, sem dúvida alguma, é na composição dos reagentes: enquanto nas reações de dupla troca percebemos duas substâncias compostas, na reação de simples troca há uma substância simples e uma substância composta.
Repare na seguinte reação de simples troca:
Cl2 + 2 NaBr → 2 NaCl + Br2
Perceba que o cloro (uma substância simples) desloca o bromo presente na substância iônica composta NaBr, fazendo com que ele seja convertido a uma nova substância simples, o Br2.
Outro ponto importante é que as reações de simples troca têm uma regra específica para ocorrência da reação. Existe uma escala de reatividade para elementos mais eletronegativos e elementos mais eletropositivos. Veja a seguir.
- Reatividade decrescente para elementos mais eletropositivos:
Metais alcalinos > Metais alcalino-terrosos > Outros metais > H > Metais nobres
- Reatividade decrescente para elementos mais eletronegativos:
F > O > Cl > Br > I > S > C
No caso, o cloro só conseguiu deslocar o bromo, pois, pela escala de reatividade, o cloro é mais reativo que o bromo. Caso contrário, a reação não ocorreria. Por exemplo:
Br2 + Cu2O → não ocorre
A reação acima não ocorre, pois o oxigênio é mais reativo que o bromo e, portanto, não é deslocado por ele.
Exercícios resolvidos sobre reação de dupla troca
Questão 1. (Unaerp Medicina/2022.2) As reações de dupla troca são aquelas que ocorrem entre substâncias compostas, havendo uma troca de espécies químicas que resulta na formação de novas substâncias compostas. A seguir, estão alguns exemplos de reações.
- BaS + H2SO4 → BaSO4↓ + H2S
- Na2S + 2 HCl → 2 NaCl + H2S
- 2 NaCl + H2SO4 → Na2SO4 + 2 HCl
- KNO3 + NaCl → KCl + NaNO3
- Na2CO3 + 2 HCl → 2 NaCl + H2O + CO2 (g)
Em relação às reações, é correto afirmar que
(A) a reação V não ocorre, já que há produção de um gás.
(B) a reação III ocorre, já que o ácido clorídrico é fraco.
(C) a reação II não ocorre, já que o H2S é um eletrólito mais forte que um dos reagentes.
(D) a reação IV ocorre, já que ambos os produtos são solúveis.
(E) a reação I ocorre, já que um dos produtos é insolúvel.
Resposta: Letra E
A alternativa A está errada, pois a reação ocorre, já que há a formação de um gás (condição para reação de dupla troca).
A alternativa B está errada, pois o ácido clorídrico é forte. O fato de formar H2S, um ácido mais fraco, é que confirma a reação.
A alternativa C está errada, pois H2S é um ácido mais fraco, sendo assim um eletrólito também mais fraco.
A alternativa D está errada, pois a reação IV não deveria ocorrer pelos critérios da reação de dupla troca, uma vez que um dos produtos deveria ser insolúvel.
A alternativa E, por fim, está correta.
Questão 2. (Unilago/2021.2) O sulfato, naturalmente presente em águas de chuva, pode ser determinado quantitativamente com base na reação entre o sulfato e o bário, representada pela equação química a seguir.
NaSO4 (aq) + Ba(NO3)2 (aq) → BaSO4 (s) + NaNO3 (aq)
Com base na equação, assinale a alternativa que apresenta o tipo de reação química envolvida na determinação de sulfato.
(A) síntese
(B) análise
(C) simples troca
(D) dupla troca
(E) substituição
Resposta: Letra D
Percebe-se a permutação entre os cátions e os ânions do sal, duas substâncias compostas, o que caracteriza uma reação de dupla troca.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
FELTRE, R. Química. V. 1, 6ª ed. Moderna: São Paulo, 2004.