Solubilidade dos Compostos Orgânicos
Existem três aspectos que devem ser considerados quando analisamos a solubilidade dos compostos orgânicos em água e entre si, que são: a polaridade, as forças de atração intermolecular e o tamanho da cadeia carbônica.
- Polaridade:
Há uma regra (que está sujeita a exceções) que se aplica não somente aos compostos orgânicos, mas à grande maioria das substâncias, no que se refere à solubilidade, que é:

Desse modo, temos que somente os compostos orgânicos que são polares é que se dissolverão na água, que também é polar (como mostrado abaixo).
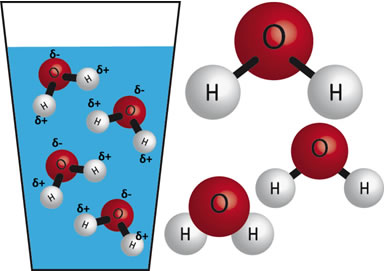
Por exemplo, o açúcar, o álcool comum, a acetona e o ácido acético encontrado no vinagre são todos compostos polares. Portanto, todos eles se dissolvem na água e também se misturam entre si, originando misturas homogêneas. Você pode verificar isso facilmente misturando álcool e vinagre.
No entanto, a maioria dos compostos orgânicos não se mistura com a água porque são apolares. Um exemplo ocorre quando alguém suja as mãos com graxa, que é um composto orgânico apolar. Não adianta tentar limpá-las com água, a graxa não sairá, porque ela não se dissolve na água. A graxa é removida quando a dissolvemos com gasolina, que também é um composto orgânico apolar.
Na imagem a seguir é mostrado um pouco de gasolina que vazou numa estrada. Note que ela não se mistura com a água:

- Forças de atração intermolecular
Embora os solutos apolares se dissolvam melhor em solventes apolares e vice-versa, existem exceções, como ocorre com a gasolina, que é apolar e se dissolve muito bem no etanol, que é polar. Assim, o mais correto é considerar a solubilidade em termos de intensidade das forças intermoleculares. A possibilidade de ocorrer a dissolução aumenta quando a intensidade das forças atrativas entre as moléculas de soluto e de solvente é maior ou igual à intensidade das forças de atração entre as moléculas do próprio soluto e entre as moléculas do próprio solvente.
O etanol é um caso especial de composto orgânico no que diz respeito à solubilidade, pois ele é infinitamente solúvel na água, que é polar, mas também dissolve muito bem materiais apolares como a gasolina. Isso acontece porque sua molécula possui uma parte apolar e uma extremidade polar, o grupo OH.
H3C ─ CH2 ─ OH
apolar polar
A parte apolar do etanol possui bastante afinidade com gasolina, tanto é que a gasolina que é vendida no Brasil possui cerca de 20% a 25% de etanol misturado em sua composição. Mas, o etanol é infinitamente solúvel em água. Isso acontece porque seu grupo OH realiza ligações de hidrogênio com as moléculas de água. Como essas forças de atração são as mais intensas, se misturássemos o etanol, a gasolina e a água, verificaríamos que o etanol seria extraído da gasolina pela água.
A sacarose (açúcar) se dissolve bem na água também porque possui vários grupos OH em sua estrutura, que realizam ligações de hidrogênio com as moléculas de água, o que facilita sua dissolução.
O óleo de cozinha possui uma solubilidade muito pequena em água, primeiro porque o óleo é apolar e a água é polar, segundo porque as moléculas de água se atraem e se agrupam com muita força (por ligação de hidrogênio) e as moléculas de óleo não conseguem ficar entre duas moléculas de água vizinhas.

É por isso que o benzeno, um hidrocarboneto apolar líquido, tem baixa solubilidade em água. As suas ligações intermoleculares são dipolo instantâneo-dipolo induzido, que são mais fracas do que as ligações de hidrogênio que as moléculas de água realizam entre si. Portanto, o benzeno não consegue separar as moléculas de água e interagir com elas.
- Tamanho das cadeias carbônicas:
Além da semelhança de polaridade e das interações intermoleculares, o tamanho aproximado das moléculas também contribui para uma maior solubilidade. Por exemplo, isso é verificado quando consideramos o ácido acético, cuja estrutura está representada a seguir. Este composto é solúvel em água em quaisquer proporções porque, assim como o álcool, o ácido acético possui uma parte hidrofílica, que tem afinidade com a água, que é a extremidade com o grupo OH; mas também possui uma parte hidrofóbica, que não tem afinidade com a água, que é a cadeia carbônica.
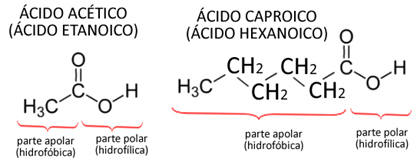
Já o ácido caproico, mostrado ao lado da estrutura do ácido acético, é parcialmente solúvel em água. Isso ocorre porque sua parte hidrofóbica é maior.

