Hidrocarbonetos
Os hidrocarbonetos são um grupo de substâncias orgânicas que possuem apenas carbono e hidrogênio em sua constituição. São divididos em classes, de acordo com as características da cadeia carbônica, podendo ser alcanos, alcenos, alcinos, alcadienos, cicloalcanos, cicloalcenos ou aromáticos. Todos os hidrocarbonetos são apolares, o que significa que não são solúveis em água.
Os hidrocarbonetos estão presentes em diversos produtos que utilizamos no nosso cotidiano, principalmente os derivados de petróleo. O petróleo, aliás, é uma mistura de hidrocarbonetos e a principal fonte desses compostos. Com os hidrocarbonetos, podemos criar variados itens de interesse, como combustíveis líquidos e gasosos, plásticos, tintas, resinas, asfalto, entre outros.
Leia também: Álcoois — compostos orgânicos que apresentam grupo hidroxila (OH) ligado a um carbono saturado
Resumo sobre hidrocarbonetos
-
Os hidrocarbonetos possuem apenas carbono e hidrogênio em sua estrutura.
-
Podem ser classificados em alcanos, alcenos, alcinos, alcadienos, cicloalcanos, cicloalcenos e aromáticos.
-
São compostos apolares, com baixa solubilidade em água.
-
Os hidrocarbonetos mais leves são gases à temperatura ambiente, por causa de sua fraca interação intermolecular.
-
São menos densos que a água.
-
Entre os hidrocarbonetos, os alcanos e os aromáticos são os mais estáveis e, assim, menos reativos.
-
Na nomenclatura, os hidrocarbonetos recebem o sufixo -o.
-
São encontrados no petróleo, gás natural e hulha, principalmente.
-
São utilizados como combustíveis, na fabricação de plásticos, resinas e tintas.
Videoaula sobre hidrocarbonetos
Classificação dos hidrocarbonetos
Entre os hidrocarbonetos, há alguns tipos diferentes, os quais podem ser classificados como:
-
Alcanos: hidrocarbonetos de cadeia aberta e saturada.
-
Alcenos: hidrocarbonetos de cadeia aberta e que possuem uma ligação dupla entre carbonos.
-
Alcinos: hidrocarbonetos de cadeia aberta e que possuem uma ligação tripla entre carbonos.
-
Alcadienos: hidrocarbonetos de cadeia fechada com duas ligações duplas entre carbonos.
-
Cicloalcanos: hidrocarbonetos de cadeia fechada e insaturada.
-
Cicloalcenos: hidrocarbonetos de cadeia fechada com a presença de ligação dupla entre carbonos.
-
Aromáticos: hidrocarbonetos de cadeia fechada e insaturada, estabilizados pelo efeito da ressonância.
Leia também: Classificação das cadeias carbônicas — aberta, fechada, saturada, insaturada
Propriedades dos hidrocarbonetos
-
Solubilidade dos hidrocarbonetos
As ligações C–H são fracamente polares, uma vez que a eletronegatividade do carbono, 2,55, é muito próxima da eletronegatividade do hidrogênio, 2,20. Os hidrocarbonetos são constituídos apenas dessas ligações e, ao se analisar suas estruturas tridimensionais, percebe-se que a polaridade resultante (momento dipolar resultante) é igual a zero ou muito próximo de zero. Como consequência, podemos afirmar que todos os hidrocarbonetos são apolares.

A Química apresenta uma regra empírica para solubilidade, chamada de “regra do semelhante”. Segundo essa regra, compostos polares só conseguem dissolver compostos polares, assim como compostos apolares só conseguem dissolver compostos apolares. Sendo assim, água e hidrocarbonetos não se solubilizam. Contudo, os hidrocarbonetos apresentam certa solubilidade em etanol (parcialmente polar) e são muito solúveis em éteres (pouco polares), por exemplo.
-
Forças intermoleculares dos hidrocarbonetos
Como substâncias apolares, os hidrocarbonetos realizam interações intermoleculares exclusivamente de caráter apolar: dipolo induzido-dipolo induzido (também chamada de Forças de London ou de Van der Waals). Essas interações são muito fracas, pois dependem de uma boa aproximação das moléculas e da criação de um dipolo instantâneo, fruto de um efeito de indução elétrica.
Quando a molécula tem um volume pequeno, a criação do dipolo instantâneo é mais difícil, pois a separação das cargas dentro de seu volume não é efetivo (afinal, como separar cargas em um pequeno volume?). Assim sendo, hidrocarbonetos de menor volume molecular interagem mais fracamente e, por isso, apresentam baixo ponto de fusão e ebulição, sendo gases à temperatura ambiente.
Conforme o volume molecular dos hidrocarbonetos aumenta, a separação de cargas é mais efetiva e as interações se intensificam. Como consequência, os pontos de fusão e ebulição vão aumentando também. O gráfico a seguir mostra as temperaturas de ebulição dos oito primeiros hidrocarbonetos de cadeia linear e aberta.
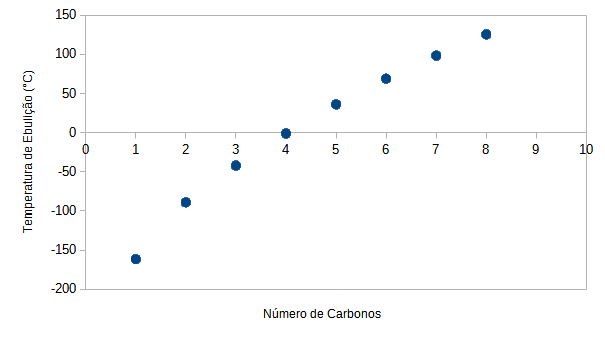
-
Densidade dos hidrocarbonetos
Os hidrocarbonetos são menos densos que a água (cujo valor de densidade é de 1,0 g/cm³). As fracas interações intermoleculares mantêm essas moléculas mais espaçadas e, consequentemente, diminuem sua densidade. É por isso que, em vazamentos de petróleo no mar, o petróleo fica sobre a superfície.
-
Reatividade dos hidrocarbonetos
Entre as classes de hidrocarbonetos, há diferença de reatividade. Os alcanos, por só possuírem ligações sigma, e os aromáticos, por apresentarem o efeito da ressonância, são os hidrocarbonetos mais estáveis, estando suscetíveis, basicamente, a reações de substituição.
Os alcenos e alcinos, por possuírem ligação pi (mais fraca que a ligação sigma), são mais reativos do que os alcanos. Reações que não ocorrem com alcanos, como adição, oxidação e redução, são possíveis em alcenos e alcinos.
Os cicloalcanos possuem estabilidade dependente do número de carbonos, pois as cadeias cíclicas são mais ou menos tensionadas de acordo com o número de carbonos. Quanto maior a tensão dentro da cadeia, menor a estabilidade.
Embora alguns autores afirmem que cicloalcanos com mais de seis carbonos são estáveis, valores experimentais mostram que o cicloalcano de seis carbonos é o mais estável, livre de tensão em sua cadeia, enquanto os de três e quatro carbonos são os mais instáveis, ou seja, com maior tensão em sua cadeia. Os demais cicloalcanos possuem tensão de anel em grau variável, e suas estabilidades devem ser avaliadas caso a caso.
Nomenclatura dos hidrocarbonetos
Toda a nomenclatura de compostos orgânicos segue as regras determinadas pela União Internacional de Química Pura e Aplicada (Iupac). Diferentemente das demais funções orgânicas, os hidrocarbonetos não possuem um grupo funcional, afinal possuem apenas carbono e hidrogênio. Todo hidrocarboneto, independentemente do tipo, possui o sufixo -o.
Para se nomear um hidrocarboneto, deve-se:
-
Identificar a cadeia principal;
-
Identificar insaturações e determinar suas posições, caso haja;
-
Identificar ramificações e determinar suas posições, caso haja.
a) Nomenclatura de alcanos
Por possuírem cadeia saturada, os alcanos devem possuir infixo -an-. Do ponto de vista da nomenclatura, o único fator a se atentar nos alcanos é a questão das ramificações. Deve-se lembrar que as ramificações são as cadeias carbônicas não pertencentes à cadeia principal, sendo que não ocorrem na extremidade da cadeia, mas sim no interior destas.
A cadeia principal é a maior cadeia que se pode identificar dentro da estrutura, iniciando-se a partir de um carbono de extremidade.
Exemplos:
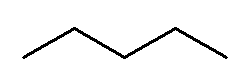
O alcano acima se chama pentano, sendo seu prefixo pent- uma referência aos cinco carbonos presentes na cadeia.
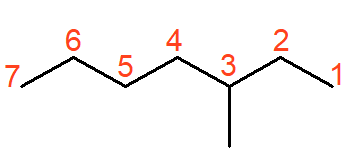
O alcano acima se chama 3-metil-heptano, um exemplo de alcano ramificado. Quando as ramificações ocorrem em hidrocarbonetos, o carbono de número 1 é o carbono da extremidade mais próxima à ramificação. Sendo assim, a numeração tem início da direita para a esquerda, conforme é visto na imagem. O nome da ramificação é “metil” pelo fato desta possuir apenas um único carbono.
b) Nomenclatura de alcenos, alcinos e alcadienos
Por possuírem cadeia insaturada, ou seja, presença de ligações duplas ou triplas entre carbonos, o infixo para alcenos, alcinos e alcadienos é diferente: -en- para alcenos e alcadienos e -in- para alcinos.
Na presença de ramificação, a cadeia deve iniciar sua contagem a partir do carbono de extremidade mais próximo à insaturação.
Exemplos:
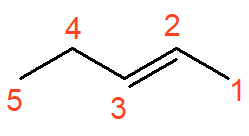
O alceno acima se chama pent-2-eno. Como a ligação dupla pode estar em qualquer carbono da cadeia, deve-se indicar sua posição no nome, junto ao infixo.
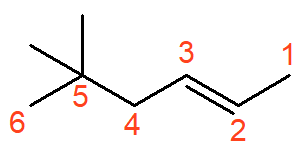
O alceno acima se chama 5,5-dimetil-hex-2-eno. A insaturação possui prioridade sobre as ramificações, por isso, o carbono 1 é o carbono mais próximo à dupla ligação.
Lembre-se que cada ramificação deve ter um número que indique sua posição e, como os dois radicais metil estão no carbono 5, a posição aparece duas vezes no nome oficial. Além disso, há a presença do prefixo di- antes do nome da ramificação, para indicar que são dois radicais.
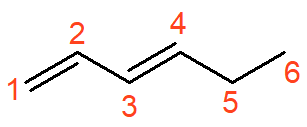
O alcadieno acima se chama hexa-1,3-dieno. O prefixo sofre uma pequena variação, de hex- para hexa-, a fim de melhorar a leitura. As duas ligações duplas devem ter suas posições indicadas no infixo, o qual é precedido por di- para indicar que são duas ligações duplas.
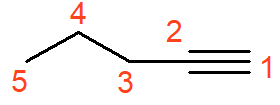
O alcino acima se chama pent-1-ino. A única diferença dos alcinos é o fato do infixo ser -in-. Estruturalmente, alguns autores representam a ligação tripla linearmente, em referência à geometria linear dos carbonos sp, como mostrado na figura. Essa representação pode gerar confusão e fazer com que a contagem de carbonos seja incorreta.
c) Nomenclatura de cicloalcanos e cicloalcenos
A nomenclatura para hidrocarbonetos cíclicos é muito parecida com os hidrocarbonetos de cadeia aberta. A diferença é que o nome da cadeia principal deve começar sempre com ciclo-.
Outro ponto importante é que, como não há carbono de extremidade (afinal, a cadeia não tem pontas), o carbono de número 1 só será determinado se houver uma ramificação ou uma insaturação.
Exemplos:
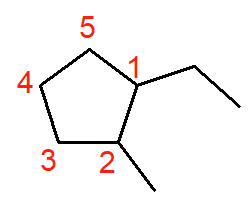
O nome deste cicloalcano é 1-etil-2-metil-ciclopentano. Como há ramificações, foi possível determinar a numeração de cada carbono. O carbono de número 1 deve ser o da ramificação etil (dois carbonos), por questão de ordem alfabética. Depois, a numeração deve girar no sentido horário, de modo que a segunda ramificação, metil, fique com o menor número possível. Visto que se trata de um cicloalcano de cinco carbonos, o nome da cadeia principal é ciclopentano.
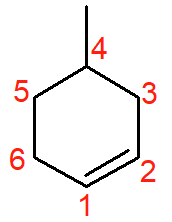
Esse cicloalceno se chama 4-metil-ciclohexeno. A insaturação (ligação dupla) possui prioridade sobre a ramificação. Os carbonos 1 e 2, ambos da insaturação, devem ser determinados de modo que a ramificação fique com o menor número possível — nesse caso, 4.
Não é necessário escrever ciclohex-1-eno, pois a Iupac não permite redundâncias no nome da cadeia. Ao se observar a estrutura, percebe-se que a ligação dupla sempre estará no carbono 1. Outro ponto importante é que, por conta da língua portuguesa, a letra h é facultativa no nome, admitindo-se também a grafia cicloexano.
d) Nomenclatura de aromáticos
Os aromáticos não possuem um nome construído segundo as regras dos hidrocarbonetos anteriores. Cada composto aromático tem um nome específico. Dentre todos, o mais conhecido e utilizado é o benzeno, de fórmula molecular C6H6.
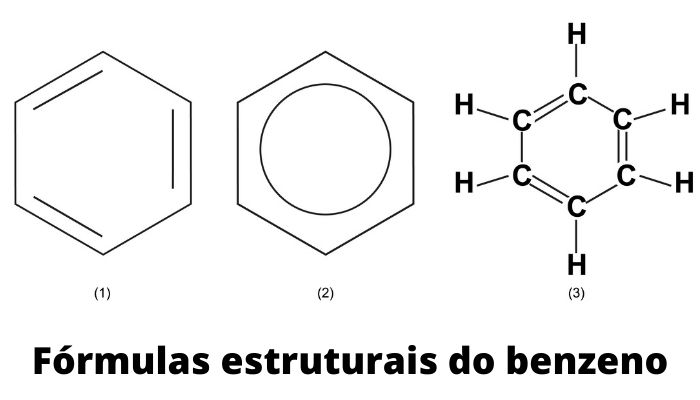
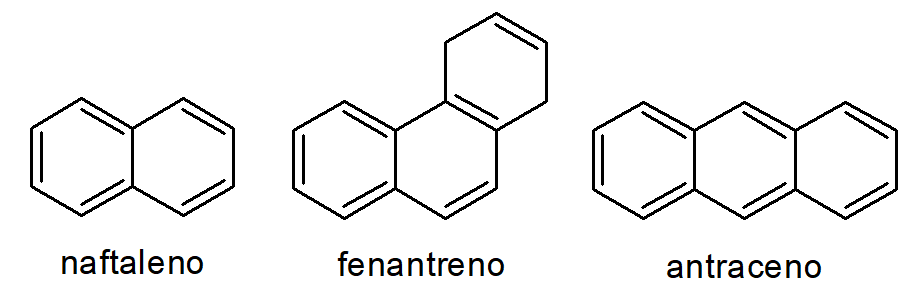
A estrutura do benzeno pode se repetir e se ligar, formando compostos mais complexos. Dessa forma, a estrutura do benzeno também é chamada de anel benzênico. A junção de mais de um anel benzênico dá origem a outros aromáticos, como, por exemplo, o naftaleno (com dois anéis benzênicos), o fenantreno e o antraceno (ambos com três anéis benzênicos).
Quando ramificado, o benzeno segue as mesmas regras dos cicloalcanos. Contudo, quando o benzeno está dissubstituído (ou seja, com duas ramificações), uma nomenclatura alternativa é possível, utilizando-se os prefixos orto-, meta- e para-.
Exemplo:
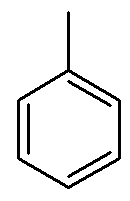
Esse composto é chamado de metil-benzeno, comercialmente conhecido como tolueno. Não é necessário escrever 1-metil-benzeno pelo fato de isso ser redundante, afinal o metil sempre estará no carbono de número 1.
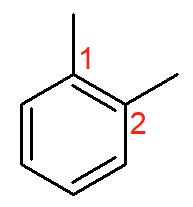
Esse composto se chama 1,2-dimetil-benzeno. O carbono de número 1 precisa ser um dos radicais metil, sendo que a segunda ramificação deve receber o menor número possível. Quando as ramificações estão na disposição acima, é possível usar um nome alternativo: orto-dimetil-benzeno ou simplesmente o-dimetil-benzeno.
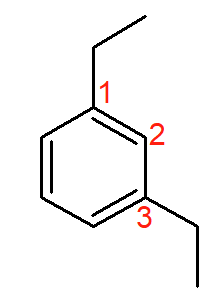
Esse composto é chamado de 1,3-dietil-benzeno. Quando as ramificações se dispõem dessa forma, os nomes alternativos possíveis são meta-dietil-benzeno ou m-dietil-benzeno.
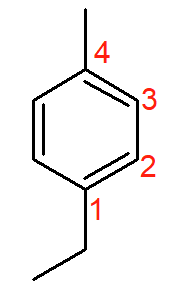
O composto da figura acima é o 1-etil-4-metil-benzeno. Os nomes alternativos para quando as ramificações ocupam as posições 1 e 4 são para-etil-metil-benzeno ou p-etil-metil-benzeno.
O naftaleno é um aromático que traz uma regra de nomenclatura diferente da convencional, utilizando as letras gregas ɑ e β.
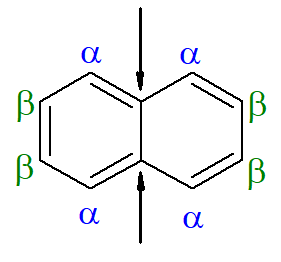
As setas marcam os carbonos de referência do naftaleno. O primeiro carbono vizinho ao carbono de referência é chamado de carbono alfa, enquanto o segundo carbono vizinho ao carbono de referência é chamado de carbono beta. Assim, logo a seguir temos o alfa-metil-naftaleno.
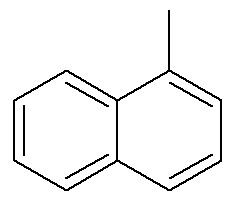
Leia também: Como fazer a numeração dos carbonos na cadeia principal de hidrocarbonetos?
Onde os hidrocarbonetos são encontrados?
A principal fonte dos hidrocarbonetos são o petróleo, a hulha e o gás natural. Tais substâncias são misturas ricas em hidrocarbonetos e, a partir de sua manipulação e refino, os diversos hidrocarbonetos podem ser encontrados.

O gás metano, o mais simples dos hidrocarbonetos, também pode ser produzido através da decomposição da matéria orgânica. Há também os organismos vivos chamados de metanogênios capazes de produzir metano a partir de dióxido de carbono e água. Tais organismos já foram encontrados em trincheiras oceânicas, lodo, esgoto e estômago de vacas.
Já o gás eteno é encontrado na natureza como forma de hormônio vegetal, sendo produzido por frutas, como tomate e banana, para auxiliar no processo de amadurecimento destas.
Função dos hidrocarbonetos
A principal utilização dos hidrocarbonetos é na produção de combustíveis, pois boa parte deles tem bom potencial energético. Por isso, estão presentes na constituição do gás natural, do gás liquefeito de propano (mistura de propano e butano), gasolina, diesel, além de combustível para aviação e navios.
Também podem ser utilizados na confecção de óleos, tintas, resinas e asfalto. A partir dos hidrocarbonetos também são feitos diversos polímeros, como o polietileno (PE) e o polipropileno (PP).
Contudo, deve-se lembrar que a queima de combustíveis à base de hidrocarbonetos intensifica a produção de CO2, um gás estufa. Os plásticos também são um sério problema, pois sua reciclagem não é facilitada e o meio ambiente não consegue degradá-los. Por isso, algumas cidades já repensam a sua utilização em diversos utensílios, como copos, sacolas e canudos, a fim de diminuir a produção de lixo plástico.

Exercícios resolvidos sobre hidrocarbonetos
Questão 1
(Fatec 2008) O gás liquefeito de petróleo, GLP, é uma mistura de propano, C3H8, e butano, C4H10.
Logo, esse gás é uma mistura de hidrocarbonetos da classe dos
A) alcanos.
B) alcenos.
C) alcinos.
D) cicloalcanos.
E) cicloalcenos.
Resposta
Letra A
Os dois componentes do GLP são o propano e o butano. Pela nomenclatura, é possível observar o infixo -an-. Além disso, não há o prefixo ciclo-. Sendo assim, ambos são alcanos.
Questão 2
(UERJ 2008) Em grandes depósitos de lixo, vários gases são queimados continuamente. A molécula do principal gás que sofre essa queima é formada por um átomo de carbono e átomos de hidrogênio.
O peso molecular desse gás, em unidades de massa atômica, é igual a:
A) 10
B) 12
C) 14
D) 16
Resposta
Letra D
O gás presente em depósitos de lixo é o gás metano, oriundo da decomposição da matéria orgânica. Isso fica ainda mais evidente quando o enunciado fala que ele é formado por um átomo de carbono e átomos de hidrogênio, ou seja, possui um único carbono, portanto deve possuir quatro átomos de hidrogênio, CH4.
O peso molecular pode ser calculado através dos valores de massa atômica do carbono (12 u) e do hidrogênio (1 u).
PMCH4 = 12 u + 4 (1 u)
PMCH4 = 16 u


