Sublimação
A sublimação é um fenômeno físico no qual uma substância passa diretamente do estado sólido para o estado gasoso, sem antes se transformar em líquido. Durante o processo, a matéria absorve energia do ambiente, o que favorece a quebra das interações entre as moléculas e permite que elas escapem para a fase gasosa mais facilmente.
A sublimação ocorre sob condições específicas de pressão e temperatura, sendo favorecida quando a pressão de vapor do sólido se iguala ou supera a pressão do ambiente. Um exemplo de substância que sublima a temperatura ambiente é o dióxido de carbono (CO2), também conhecido por gelo seco, muito utilizado em produções cinematográficas e shows para gerar o efeito de neblina.
Leia também: Os três estados físicos da matéria
Resumo sobre sublimação
- A sublimação é a passagem direta de um sólido para o estado gasoso, sem passar pela fase líquida.
- É um processo endotérmico, pois ocorre com a absorção de energia do ambiente.
- Moléculas com interações intermoleculares fracas apresentam maior facilidade de passar para o estado de vapor.
- A sublimação é favorecida quando a pressão de vapor do sólido é maior que a pressão do ambiente.
- O dióxido de carbono, conhecido por gelo seco, é um exemplo de substância que sofre sublimação.
O que é sublimação?
A sublimação é a transição direta de uma substância do estado sólido para o estado gasoso, sem passar pela fase líquida. Esse processo ocorre em substâncias que têm uma pressão de vapor significativa em temperaturas abaixo do seu ponto de fusão.
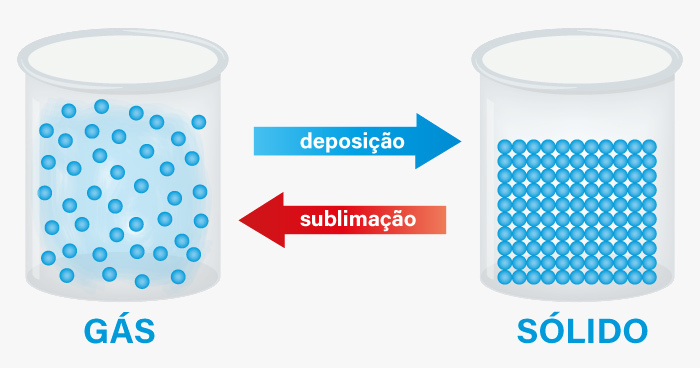
O processo inverso, no qual o gás se transforma diretamente em sólido, é conhecido como deposição ou ressublimação. Ainda assim, o termo sublimação também é utilizado para indicar a passagem direta do estado gasoso para o sólido.
Como funciona a sublimação?
A sublimação ocorre quando as moléculas de um sólido recebem energia suficiente para romper as forças intermoleculares que as mantêm em uma estrutura rígida. Esse processo é endotérmico, ou seja, absorve energia do ambiente para que ocorra.
Em geral, quanto menor é a interação intermolecular entre as moléculas, maior é a facilidade que elas têm de passar para o estado gasoso. Isso define a volatilidade de uma substância e resulta no aumento da sua pressão de vapor.
A pressão de vapor de um sólido refere-se à pressão exercida pelas moléculas que escapam da superfície do sólido para o estado gasoso, durante o equilíbrio entre as duas fases. Para que ocorra a sublimação, é necessário que a pressão de vapor do sólido seja suficientemente alta em determinada temperatura.
Quando a pressão de vapor do sólido se iguala ou supera a pressão do ambiente, as moléculas do sólido podem escapar diretamente para a fase gasosa, sem passar pelo estado líquido. Assim, quanto maior a pressão de vapor de um sólido, maior será a tendência de sublimação, especialmente em condições de baixa pressão e temperatura moderada.
-
Diagrama de fases
O diagrama de fases é uma ferramenta útil para entender as condições de pressão e temperatura em que uma substância pode existir nos estados sólido, líquido e gasoso. Para entender melhor essa relação, vamos analisar o diagrama de fases do CO2 a seguir.
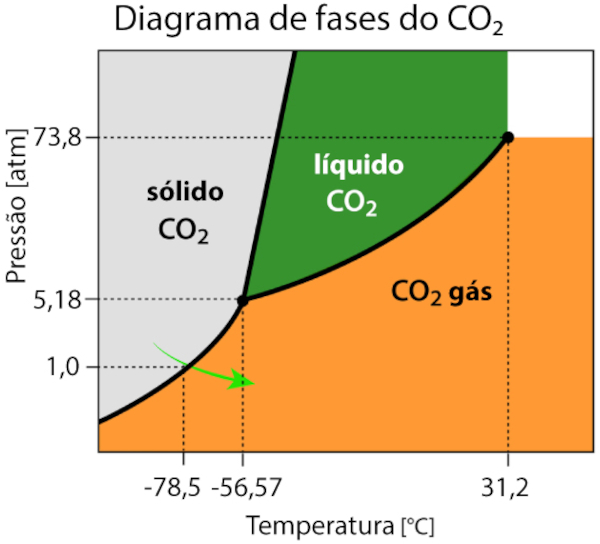
O diagrama de fases do caso do dióxido de carbono (CO₂) mostra que, na pressão de 1 atm e na temperatura de -78,5 °C, a substância passa diretamente do estado sólido para o gasoso, caracterizando a sublimação.
O gráfico também mostra que, para o CO2 existir na fase líquida, é necessário que a substância esteja submetida a uma pressão de, no mínimo, 5,1 atm e temperatura de -56,57 °C.
Isso justifica o fato de o CO2 sublimar em condições normais de temperatura e pressão (CNTP) e nos ajuda a entender por que em regiões de altitudes elevadas, que apresentam pressões mais baixas, a sublimação ocorre em temperaturas ainda menores.
Leia também: Plasma — o estado físico das estrelas
Exemplos de sublimação
Existem algumas substâncias que sofrem sublimação e são muito úteis nas mais variadas atividades do nosso cotidiano, como veremos a seguir.
- Gelo seco: é o CO2 no estado sólido, utilizado na refrigeração de alimentos e no transporte de materiais biológicos devido à sua capacidade de manter temperaturas muito baixas sem molhar os produtos, uma vez que não se converte em líquido. Em shows e eventos, a sublimação do gelo seco cria efeitos visuais de “neblina”, amplamente utilizados em teatros e produções cinematográficas. No entanto, é necessário cuidado ao manuseá-lo, pois o contato direto com a pele pode causar queimaduras pelo frio intenso, e a inalação de grandes quantidades de CO2 pode representar risco à saúde.

- Naftalina: muito utilizada como repelente de insetos, a naftalina sublima lentamente a temperatura ambiente, liberando vapores que afastam traças e outros insetos. Embora eficaz, o uso da naftalina requer cuidado, pois seus vapores podem ser tóxicos em ambientes fechados e causar irritação respiratória em humanos.

- Cânfora: é uma substância cristalina e incolor que também sofre sublimação em temperatura ambiente. Devido ao seu cheiro fresco e penetrante, a cânfora é usada para odorizar ambientes e ajuda a repelir insetos. Além disso, a cânfora é utilizada em certos incensos e em preparações aromáticas para purificar o ar e criar um ambiente com cheiro refrescante. Contudo, o uso deve ser moderado, pois, em concentrações altas, o cheiro pode ser considerado forte demais.

- Iodo: é um sólido negro e de brilho metálico que sofre sublimação quando aquecido, liberando vapores de cor violeta característicos. É utilizado em experimentos químicos e processos industriais. No entanto, o seu manuseio deve ser feito com cuidado, pois seus vapores podem ser irritantes para os olhos e o trato respiratório.

Exercícios sobre sublimação
Questão 1
(UCS - 2023) A busca pelo café sem cafeína tem mobilizado estudiosos do mundo inteiro para atender a demanda crescente de pessoas que querem se livrar dos efeitos colaterais provocados por essa substância estimulante, como insônia e aumento da pressão arterial. Hoje em dia, esse tipo de produto responde por cerca de 10% do mercado mundial de café. Para ser considerado descafeinado, o valor permitido de cafeína, de acordo com a Resolução da Diretoria Colegiada nº 277 da Agência Nacional de Vigilância Sanitária, deve ser de no máximo 0,1% em massa. A maioria dos métodos de descafeinação utiliza extrações do tipo sólido-líquido mediadas por solventes orgânicos e água, mas que nem sempre apresentam bons resultados em termos de eficiência. Nesse sentido, a indústria do café tem sido obrigada a investir cada vez mais em tecnologia para continuar oferecendo um produto diferenciado no mercado.
A extração com dióxido de carbono supercrítico é o que há de mais moderno em termos de inovação no mundo dos descafeinados. Acima da temperatura e pressão críticas, o CO2 adquire uma densidade similar à de um líquido e simultaneamente uma viscosidade parecida com a de um gás. Nessa condição, o grande poder de solvatação ocasiona uma alta permeação do fluido nos grãos de café, aumentando a probabilidade de uma extração completa. Apesar de o custo ser relativamente alto, esse tipo de extração permite que o gás carbônico seja reaproveitado, enquanto a cafeína extraída pode ser vendida para empresas que produzem medicamentos, cosméticos, energéticos e diversos outros produtos.
Disponível em: https://paribar.com.br/cafe-descafeinado/. Acesso em: 21 ago. 2022. (Parcial e adaptado.)
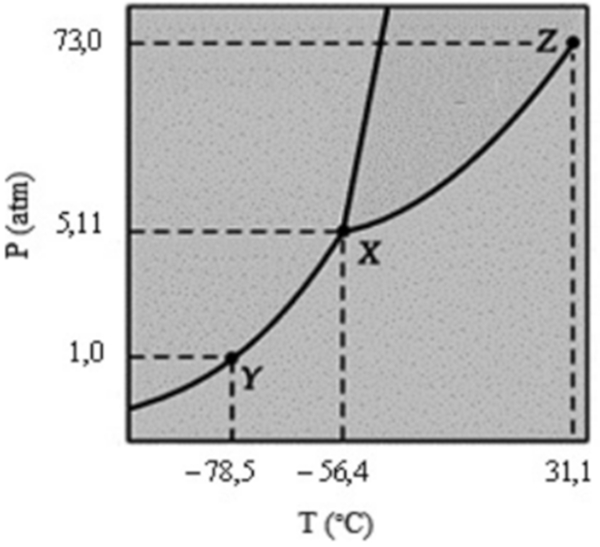
O diagrama de fases que evidencia o comportamento do CO₂, em função da temperatura e da pressão, encontra-se representado acima. Com base nessas informações, é correto afirmar que
A) o dióxido de carbono, no ponto Y, encontra-se exclusivamente no estado sólido.
B) o ponto de fusão do dióxido de carbono aumenta com o aumento da pressão.
C) o dióxido de carbono, no ponto X, torna-se supercrítico e pode ser utilizado na extração da cafeína.
D) a sublimação do dióxido de carbono ocorrerá para quaisquer valores de P e T situados entre X e Z.
E) os três estados físicos do dióxido de carbono, no ponto Z, coexistem em equilíbrio.
Resposta: Alternativa B
Com base no diagrama de fases, o ponto de fusão do dióxido de carbono aumenta com a pressão.
- Alternativa A) está incorreta. O dióxido de carbono, no ponto Y, encontra-se no estado sólido e gasoso.
- Alternativa C) está incorreta. No ponto X, o dióxido de carbono encontra-se no ponto triplo (nas três fases da matéria: sólida, líquida e gasosa). O ponto crítico é o ponto Z.
- Alternativa D) está incorreta. A sublimação do dióxido de carbono ocorre para qualquer valor de P e T, situados entre X e Y. Entre X e Z ocorre a vaporização.
- Alternativa E) está incorreta. O ponto Z é o ponto crítico. Os três estados físicos do dióxido de carbono coexistem no ponto X, que é ponto triplo.
Questão 2
Considere a sublimação da naftalina. Para que o processo ocorra, a substância deve absorver uma quantidade significativa de energia. O que esse ganho de energia provoca na estrutura molecular da naftalina?
A) O ganho de energia aumenta a coesão entre as moléculas, favorecendo a passagem para o estado gasoso.
B) As moléculas de naftalina perdem energia cinética e se reorganizam no estado gasoso.
C) O ganho de energia faz com que as moléculas vibrem mais intensamente, rompendo as forças intermoleculares que mantêm a estrutura sólida.
D) A sublimação ocorre quando as moléculas da naftalina ganham energia suficiente para aumentar a sua interação no estado líquido.
E) A absorção de energia fortalece as interações entre as moléculas, permitindo que a naftalina passe diretamente do sólido para o líquido.
Resposta: Alternativa C
O ganho de energia faz com que as moléculas vibrem mais intensamente, rompendo as forças intermoleculares que mantêm a estrutura sólida.
Alternativa A) está incorreta. O ganho de energia diminui as forças de coesão entre as moléculas, e isso favorece a passagem para o estado gasoso.
Alternativa B) está incorreta. As moléculas de naftalina ganham energia cinética devido à absorção de energia do ambiente. Além disso, o estado gasoso é desorganizado devido ao aumento de energia cinética.
Alternativa D) está incorreta. Durante a sublimação, as moléculas da naftalina não passam pelo estado líquido e as suas interações diminuem devido ao aumento de energia.
Alternativa E) está incorreta. A absorção de energia não fortalece as interações entre as moléculas de naftalina. Na sublimação, as moléculas não passam da fase sólida para a fase líquida, mas para a fase gasosa.
Fontes
ATKINS, P. W. PAULA, J. de. Físico-Química, Vol. 1. - 10. ed.- Rio de Janeiro: LTC, 2018.
ATKINS, Peter; JONES, Loretta; Princípios de química: questionando a vida moderna e o meio ambiente. - 3. ed.- Porto Alegre: Bookman, 2006.
BROWN, Theodore L. et al. Química: a ciência central. - 9. ed. - São Paulo: Prentice Hall, 2005.
CHANG, Raymond; Química Geral: Conceitos Essenciais. - 4. ed. - São Paulo: McGraw-Hill, 2007.


