Cálculos com a Lei de Proust
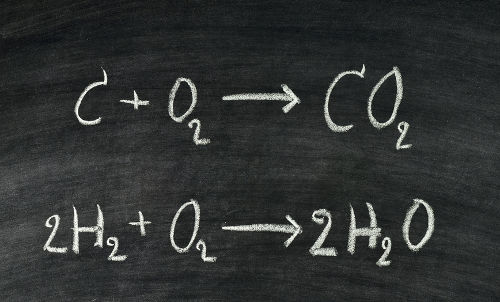
Este texto tem como objetivo abordar como são realizados os cálculos com a Lei de Proust, nos quais são utilizados os princípios descobertos pelo químico francês Joseph Louis Proust durante experimentos envolvendo as massas dos componentes de uma reação química. Esses princípios são:
-
Os participantes de uma reação sempre reagem com uma proporção definida e constante;
-
Uma reação só ocorre se houver uma proporção definida entre os participantes.
Se tivermos a seguinte reação química genérica:
A + B → C + D
ma mb mc md
Em que ma, mb, mc e md são as massas dos participantes, de acordo com os cálculos com a Lei de Proust, elas seguem uma proporção definida, ou seja, se a proporção é 1:2:1:2, temos que:
-
A massa de A é igual a massa de C;
-
A massa de B é igual a massa de D;
-
A massa de B e de D é o dobro da massa de A e de C.
Se realizarmos um novo experimento com essa mesma reação química, porém utilizando valores de massas diferentes, os cálculos com a lei de Proust confirmam a proporção em massa definida quando realizamos o seguinte procedimento:
ma = mb = mc = md
ma) = mb) = mc) = md)
De uma forma geral, os cálculos com a Lei de Proust são muito utilizados em exercícios relacionados a cálculo estequiométrico. A seguir, veja alguns exemplos de exercícios que utilizam cálculos com a lei de Proust:
Obs.: Vale ressaltar que a Lei de Proust, muitas vezes, é utilizada em associação com a Lei de Lavoisier, já que ambas são leis ponderais.
1º Exemplo - (Vunesp-SP) Foram analisadas três amostras (I, II e III) de óxidos de enxofre, procedentes de fontes distintas, obtendo-se os seguintes resultados:
Esses resultados mostram que:
a) as amostras I, II e III são do mesmo óxido.
b) apenas as amostras I e II são do mesmo óxido.
c) apenas as amostras II e III são do mesmo óxido.
d) apenas as amostras I e III são do mesmo óxido.
e) as amostras I, II e III são de óxidos diferentes.
Para resolver a questão, devemos realizar as seguintes etapas:
-
1ª etapa: Montar e balancear a equação química, na qual o enxofre (S) reage com o gás oxigênio (O2) e forma o dióxido de enxofre (SO2):
1 S + 1 O2 → 1 SO2
-
2ª etapa: Determinar a massa molar de cada um dos componentes da equação.
1 S = 32 g/mol
1 O2 = 2.16 = 32 g/mol
1 SO2 = 1.32 + 2.16 = 64 g/mol
Esse resultado permite-nos avaliar que a massa de enxofre que deve reagir é igual à massa do gás oxigênio, resultando no dobro de massa para o dióxido de enxofre. Assim, a proporção da reação é de 1:1:2.
-
3ª etapa: Verificar em qual das amostras a proporção obtida na etapa 2 é obedecida. Para isso, basta analisar se as massas de S e O2 são iguais, e a massa de SO2 é o dobro delas:
Amostra 1: a massa de S é 0,32 g, a massa de O2 é 0,32 g e a massa de SO2 é 0,64 g, ou seja, essa amostra obedece a proporção 1:1:2.
Amostra 2: a massa de S é 0,8 g, a massa de O2 é 0,8 g e a massa de SO2 é 0,16 g, ou seja, a amostra obedece a proporção 1:1:2.
Amostra 3: a massa de S é 0,32 g, a massa de O2 é 0,48 g e a massa de SO2 é 0,80 g, ou seja, a amostra não obedece a proporção 1:1:2.
2º Exemplo - (Uni-Facef-SP) Foram realizados dois experimentos cujos dados constam na tabela.
Os valores de x, y e z, em gramas, que completam, correta e respectivamente, a tabela são:
a) 4,0; 12,0 e 12,5.
b) 16,0; 6,0 e 5,5.
c) 4,0; 0,75 e 1,25.
d) 16,0; 0,75 e 0,25.
e) 4,0; 1,5 e 2,0.
Para a resolução desse exemplo, devemos realizar as seguintes etapas:
-
1ª etapa: Utilizar a Lei de Lavoisier para determinar o valor de x, já que, de acordo com essa lei, a soma das massas dos reagentes é igual à soma das massas dos produtos:
6 + x = 10
x= 10 - 6
x = 4 g
-
2ª etapa: Utilizar a Lei de Proust para determinar o valor de y, já que essa lei trabalha a proporção definida entre os experimentos, logo:
6 = 4
y 0,5
Multiplicando cruzado, temos:
4.y = 6.0,5
4y = 3
y = 3
4
y = 0,75 g
-
3ª etapa: Utilizar a Lei de Lavoisier para determinar o valor de x, já que, de acordo com essa lei, a soma das massas dos reagentes é igual à soma das massas dos produtos:
0,75 + 0,5 = z
z= 1,25 g
3º Exemplo - (UEL-PR) Verifica-se, experimentalmente, que 2,0 g de hidrogênio reagem completamente com 0,50 mol de oxigênio para formar água. Repetindo a experiência com 24 x 1023 moléculas de hidrogênio, quantos mols de oxigênio serão necessários?
a) 0,50
b) 1,0
c) 1,5
d) 2,0
e) 4,0
Trata-se de um exercício em que utilizamos os cálculos com a Lei de Proust relacionados à estequiometria. Isso porque, no enunciado, temos a presença de dados em mol e moléculas. Para resolver essa questão, devemos realizar as seguintes etapas:
-
1ª etapa: Montar e balancear a equação, na qual, o hidrogênio (H2) reage com o gás oxigênio (O2) e forma água (H2O):
2 H2 + 1 O2 → 2 H2O
-
2ª Etapa: Transformar a massa de hidrogênio fornecida para mol.
1 mol de H2------2 g
y mol------------2g
2.y = 2.1
y = 1 mol
-
3ª etapa: Transformar o valor fornecido em moléculas para mol.
6 x 1023 moléculas de hidrogênio--------1 mol
24 x 1023 moléculas de hidrogênio--------x mol
6 x 1023 x = 24 x 1023
x = 24 x 1023
6 x 1023
x = 4 mol
-
4ª etapa: Determinar o número de mol de gás oxigênio utilizando a Lei de Proust, já que temos duas experiências sendo realizadas e, de acordo com essa lei, os participantes seguem uma proporção definida.
H2 O2
1 = 0,5
4 z
1.z = 4.0,5
z = 2 mol



