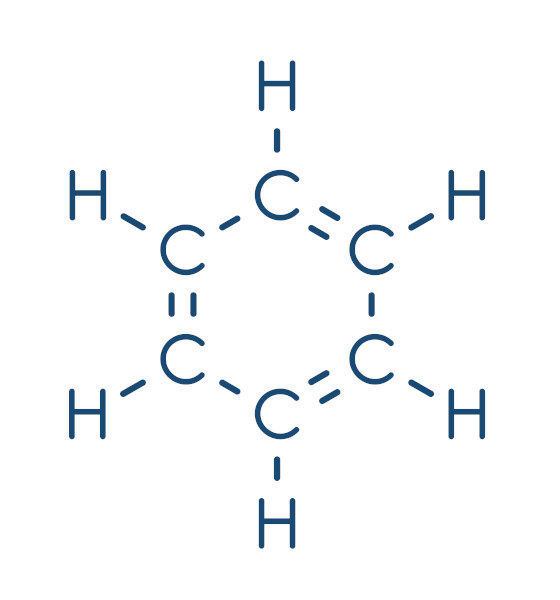
Benzeno
O benzeno, além de possuir diversas aplicações industriais e comerciais, é uma das substâncias mais comuns e importantes da Química Orgânica, servindo como base para classificar os hidrocarbonetos aromáticos.
Fórmula
O benzeno possui uma estrutura extremamente estável do ponto de vista químico. Sua fórmula estrutural é composta por seis átomos de carbono nos vértices de um hexágono, com duplas alternadas, e um átomo de hidrogênio ligado a cada carbono, conforme mostrado nas diferentes formas de representação desse composto.
.jpg)
Esse modelo de estrutura foi elaborado pelo químico alemão Friedrich August Kekulé, em 1866, e possibilitou explicar as características do benzeno, além de ter auxiliado no avanço de pesquisas em torno desse composto.
O benzeno apresenta-se com duas possibilidades de estruturas, ambas com a mesma quantidade de energia envolvida, alterando-se apenas a posição das duplas ligações entre os carbonos. O que ocorre é que as estruturas sofrem o que chamamos de ressonância, ou seja, ocorre uma alternância entre as duplas ligações da estrutura.

Sua estrutura, na realidade, é um intermediário entre as duas mostradas anteriormente representado da seguinte forma:
.png)
O círculo interno representa a ressonância existente entre as estruturas do benzeno. Essa ressonância estabiliza a molécula, fazendo com que o benzeno seja pouco reativo.
Leia também: Reações de substituição no benzeno
Características
O benzeno é um hidrocarboneto aromático de fórmula molecular C6H6 e massa molar 78,11 g/mol. É considerado uma substância-base para os compostos aromáticos, por ser o mais simples desse grupo de compostos. Na temperatura ambiente, é um líquido incolor de densidade 876 kg/m³ que apresenta um cheiro adocicado característico, porém sua inalação pode causar danos à saúde.
Sua temperatura de fusão é 5,5 °C e sua temperatura de ebulição é 80,1 °C. Seu baixo ponto de ebulição explica uma das características do benzeno: a volatilidade. Ou seja, o benzeno é um líquido de rápida evaporação, libera vapores com facilidade. Para efeito de comparação, o benzeno possui uma volatilidade três vezes maior do que a água.
O benzeno também é uma substância extremamente inflamável e pouco solúvel em água, devido a sua polaridade.
Onde é encontrado
O benzeno é liberado na natureza, em menor escala, por atividades vulcânicas e queimadas, mas sua fonte principal de emissão dá-se por meio de atividades humanas, nos processos industriais.
Em escala industrial, o benzeno é produzido pela destilação do petróleo bruto, sendo um dos subprodutos formados nesse processo, ou ainda por síntese, com base em hidrocarbonetos menores.
Polaridade
Assim como os outros hidrocarbonetos, o benzeno possui uma molécula apolar. O que explica sua baixa solubilidade em água (um solvente polar) e sua utilização como solvente orgânico.
Leia também: Polaridade das moléculas
Nomenclatura
O benzeno foi descoberto pelo químico e físico britânico Michael Faraday, em 1825, no gás utilizado na iluminação da cidade de Londres.
Em 1834, o químico alemão Eilhardt Mitscherlich determinou sua fórmula molecular (C6H6) e também propôs inicialmente seu nome, benzine, pois a substância havia sido encontrada no ácido benzoico, que, por sua vez, foi obtido com base na essência do benjoeiro (uma árvore nativa da Sumatra).
Quando se trata da nomenclatura oficial de compostos aromáticos, ou seja, que possuem o benzeno em sua estrutura, existe uma regra específica para essas cadeias carbônicas divididas em dois grupos. O primeiro caso ocorre quando há apenas um grupo substituinte ligado ao benzeno; e o segundo, quando há dois ou mais grupos ligados ao anel.
Para o primeiro grupo, o nome segue esta regra:
NOME DO SUBSTITUINTE + BENZENO
Como nos exemplos seguintes:

Para o segundo grupo, o nome segue esta regra:
POSIÇÃO DOS SUBSTITUINTES + NOME DOS RADICAIS + BENZENO
Segue o exemplo:
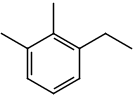
Note que, no exemplo anterior, a ordem da posição dos radicais segue a ordem alfabética.
Quando o anel possui apenas dois grupos ligados a ele, podemos contar com uma nomenclatura especial para esse tipo de composto, já que existem apenas três opções: 1,2 ou orto (o); 1,3 ou meta(m); e 1,4 ou para(p). Seguem-se os exemplos:
.png)
Aplicações
O benzeno é utilizado como matéria-prima de diversos outros compostos orgânicos (estirenos, plásticos, polímeros etc.) e como aditivos em combustíveis automotivos. Na indústria alimentícia, está presente na formulação de refrigerantes.
O benzeno também já foi utilizado como solvente orgânico de tintas, diversos tipos de colas etc. Porém, pelo fato de ser uma substância tóxica, foi substituído por outros tipos de solventes, como o tolueno, que possui características químicas parecidas, mas não é cancerígeno.
Veja também: Aplicação da Radioatividade na Medicina
Curiosidades
- O benzeno já foi utilizado como loção pós barba, por causa do seu cheiro agradável, no início do século XX.
- A Agência Internacional de Pesquisa sobre o Câncer, ligada à OMS, classifica o benzeno no Grupo 1, ou seja, como um composto extremamente carcinogênico em seres humanos.
- Kekulé descobriu a estrutura do benzeno após ter tido um sonho, em que uma serpente engolia a própria cauda, formando assim um ciclo. É claro que depois de muitos estudos e preparação sobre o tema, foi possível interpretar e aplicar a observação do sonho.
- Atualmente, no Brasil, sua utilização é controlada pela Anvisa, pois há vários casos de intoxicação por meio dessa substância registrados.
Leia também: Substâncias tóxicas formadas na incineração do lixo
Toxicidade
Fazendo jus a sua volatilidade, a principal forma de intoxicação do benzeno é pela inalação. Uma rápida exposição ao benzeno pode causar tonturas, sonolência, tremores e até inconsciência.
Em casos mais graves e de longas exposições, o benzeno pode causar leucopenia (baixo nível de glóbulos brancos no sangue), anemia e até levar ao surgimento de câncer.