Cálculos envolvendo difusão e efusão dos gases

Para entender como realizar os cálculos envolvendo difusão e efusão dos gases, é necessário, antes de mais nada, relembrar os conceitos desses dois tipos de movimentos realizados pelas partículas de um gás:
-
Difusão: é o movimento espontâneo das partículas de um gás no sentido de se espalhar uniformemente em um recipiente ou em meio às partículas de outro gás;
-
Efusão: é o movimento espontâneo das partículas de um gás no sentido de atravessar um orifício do recipiente onde elas estão contidas.
Fórmulas para cálculos envolvendo difusão e efusão dos gases
a) Gases diferentes submetidos à mesma temperatura
Se tivermos dois gases diferentes (A e B) submetidos à mesma temperatura, a relação de suas velocidades será sempre igual à raiz quadrada da divisão do inverso de suas massas molares:
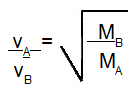
-
vA = velocidade de difusão ou efusão do gás A;
-
vB= velocidade de difusão ou efusão do gás B;
-
MA= Massa molar do gás A;
-
MB= Massa molar do gás B.
De acordo com os estudos realizados pelo químico Thomas Graham, quando dois gases diferentes estão submetidos à mesma temperatura, suas velocidades (vA e vB) são inversamente proporcionais à raiz quadrada de suas densidades absolutas:
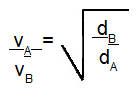
-
vA = velocidade de difusão ou efusão do gás A;
-
vB = velocidade de difusão ou efusão do gás B;
-
dB = densidade do gás B;
-
dA = densidade do gás A.
c) Mesmo gás em temperaturas diferentes
Se submetermos um mesmo gás a condições de temperatura diferentes em diferentes momentos, em cada um deles, o gás apresentará diferentes velocidades, as quais serão diretamente proporcionais à raiz quadrada da divisão das temperaturas inicial e final:
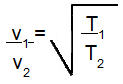
-
v1 = velocidade do gás no instante inicial;
-
v2 = velocidade do gás no instante final;
-
T1 = temperatura do gás no instante inicial;
-
T2 = temperatura do gás no instante final.
Não pare agora... Tem mais depois da publicidade ;)
d) Unidade de medida utilizada para a velocidade de difusão e efusão
-
Litro por minuto (L/min);
-
Quilômetro por minuto (km/min);
-
Quilômetro por hora (km/h).
Exemplos de cálculos envolvendo difusão e efusão dos gases
Exemplo 1- Um determinado gás X é adicionado a um recipiente, que está submetido a uma temperatura de 27oC. Verifica-se que sua velocidade de difusão pelo espaço do recipiente é de 4,5 km/min. Se o recipiente estivesse em uma temperatura de 47 oC, qual seria a velocidade de difusão do gás X?
Dados fornecidos pelo exercício:
T1 = 27oC;
v1 = 4,5 km/min;
T2 = 47oC.
1o Passo: Transformar a temperatura inicial para Kelvin somando-a com 273:
T1 = 27 + 273
T1 = 300 K
2o Passo: Transformar a temperatura final para Kelvin somando-a com 273:
T1 = 47 + 273
T1 = 320 K
3o Passo: Por fim, basta utilizar os valores fornecidos na expressão abaixo:
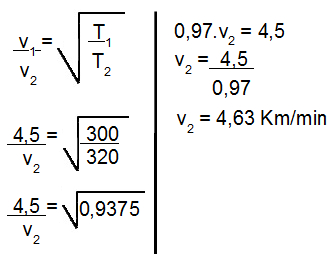
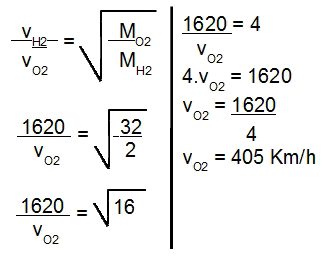
Exemplo 2- (Mackenzie-SP) A velocidade de difusão do gás hidrogênio é igual a 27 km/min, em determinadas condições de pressão e temperatura. Nas mesmas condições, a velocidade de difusão do gás oxigênio em km/h é de:
a) 4km/h
b) 108km/h
c) 405km/h
d) 240km/h
e) 960km/h
Dados fornecidos pelo exercício:
vH2= 27 km/min
vO2= ?
1o Passo: Determinar a massa molar do H2 multiplicando a quantidade de átomos (2) pela massa molar de cada hidrogênio.
MH2 = 2.1
MH2 = 2 g/mol
2o Passo: Determinar a massa molar do O2 multiplicando a quantidade de átomos (2) pela massa molar de cada oxigênio.
MO2 = 2.16
MO2 = 3 g/mol
3o Passo: Transformar a velocidade do H2 de km/min para km/h apenas multiplicando por 60:
vH2 = 27.60
vH2= 1620 km/h
4o Passo: Por fim, basta utilizar os valores fornecidos na expressão abaixo:
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















